Inhaltsverzeichnis
75 Zur Bewertung von Entkälkungsmitteln aus dem Jahre 1968
Sonderdruck aus LEDER- UND HÄUTEMARKT Beilage Gerbereiwissenschaft und Praxis Januar 1968
Untersuchungen zum Entkälkungs- und Beizprozess
Von H. Herfeld und I. Steinlein
Aus der Versuchs- und Forschungsanstalt für Ledertechnik der Westdeutschen Gerberschule Reutlingen
Valuation of deliming products
For the valuation of deliming products and the comparison of their prices, one proposes four distinctive figures: deliming value, pH value, buffing value and lime dissolving value. For these four values Instructions for analysis are given as well as indications on valuation of the results.
Die Aufgabe des Entkälkungsprozesses besteht darin, die Entkälkungschemikalien zu neutralisieren, den beim Äschern aufgenommenen Kalk weitestmöglich zu entfernen und gleichzeitig damit die Äscherschwellung rückgängig zu machen. Das kann entweder mit Säuren bzw. infolge Hydrolyse sauer reagierenden Salzen (Bisulfit) oder mit Ammonsalzen oder mit Mischungen von Säuren und deren Ammonsalzen erfolgen. Um Entkälkungsmittel bewerten und preislich vergleichen zu können, ist einmal erforderlich, ihren Entkälkungswert zu kennen, d. h. zu wissen, welche Menge nötig ist, um eine bestimmte Kalkmenge zu neutralisieren. Das reicht aber nach neueren technologischen Untersuchungen nicht aus, denn dieser Wert erfasst nur den ersten Teil des Entkälkungsvorganges, die Umwandlung des Kalkes in Kalksalze (und natürlich die Neutralisation des Schwefelnatriums), er sagt aber nichts darüber aus, ob die gebildeten Kalksalze leicht löslich sind und damit gut aus der Haut entfernt werden können oder ob sie schwer löslich sind und damit teilweise in der Haut verbleiben. Solange in langer Flotte gearbeitet wird, spielt diese Tatsache zumeist keine große Rolle, weil dann die meisten schwerer löslichen Kalksalze (z. B. das sich beim Arbeiten mit Ammonsulfat bildende Calciumsulfat) noch zum erheblichen Teil in der Flotte gelöst bleiben, und ein verbleibender unlöslicher Rest vorwiegend außerhalb der Haut in der Flotte zur Abscheidung gelangt. Wird aber ohne oder mit kurzer Flotte gearbeitet - und diese Arbeitsweise setzt sich in der Praxis immer mehr durch -, so haben unsere vergleichenden Untersuchungen über die technologischen Möglichkeiten zur Vereinfachung und Beschleunigung der Naßarbeiten bei der Herstellung von Rindoberleder insbesondere für die Arbeitsvorgänge des Entkälkens und Pickelns deutlich gezeigt, daß unlösliche Niederschläge möglichst zu vermeiden sind, da bei kurzer Flotte zwangsläufig die Menge des Unlöslichen ansteigt, und außerdem die Niederschläge sich zum erheblichen Anteil innerhalb der Haut ausscheiden, damit Griff und Narbenbeschaffenheit ungünstig beeinflussen und die Diffusion der Chemikalien bei den nachfolgenden Arbeitsprozessen verzögern. Dieser Nachteil tritt um so stärker in Erscheinung, je dicker das zu entkälkende Hautmaterial ist, also z. B. beim Spalten nach der Chromgerbung stärker als beim Spalten nach dem Äscher, und je kurzfristiger gearbeitet werden soll. Die übliche Prüfung des Hautschnittes mit Phenolphthalein gibt bekanntlich nur über den ersten Teilprozess der Neutralisation Auskunft, nicht über den Grad der Löslichkeit des gebildeten Kalksalzes. Die in den Werbevorschriften der Lieferfirmen gemachten Angaben geben meist keine vergleichbaren Werte, insbesondere keine Angaben über das Verhalten bei kurzer Flotte. Daher haben wir eine Methode für die Bestimmung einer Kalklöslichkeitszahl entwickelt, die dem Praktiker hierüber nähere Angaben vermitteln und die richtige Auswahl der Entkälkungsmittel beim Arbeiten in kurzer Flotte erleichtern soll.
Neben dem Entkälkungswert und der Kalklöslichkeitszahl interessiert für die Charakterisierung eines Entkälkungsmittels häufig auch der pH-Wert, den das Entkälkungsmittel in wässeriger Lösung vermittelt. Wir hatten in dem schon erwähnten Bericht über die Rationalisierung der Naßarbeiten auch darauf hingewiesen, daß beim Entkälkungsvorgang der pH-Wert auch nicht kurzfristig unter 5 absinken sollte, da bei pH-Werten unter 5 der noch in der Haut befindliche Grund und die verseiften Hautfette ausgefällt werden, sich im Narben festsetzen und dann nur noch schwer, jedenfalls nur noch durch ein mechanisches Streichen zu entfernen sind, auf das man heute zumeist aus Kostengründen verzichten will. Je saurer die Entkälkungsmittel von Haus aus sind, desto größer ist die Gefahr, daß der pH-Wert zeitweise in der Flotte und in den Außenschichten der Haut unter 5 absinkt, weshalb wir empfohlen haben, Entkälkungsmittel stets mittels Dosiereinrichtung dem Entkälkungsbad so zuzugeben, daß der pH-Wert nie unter 5 absinken kann. Ist eine solche Dosiervorrichtung nicht vorhanden, so wird das Entkälkungsmittel zweckmäßig in einzelnen Portionen zugegeben, und der pH-Wert macht den Praktiker darauf aufmerksam, ob und in welchem Maße er bei dem gewählten Entkälkungsmittel auf diesen Faktor bei der praktischen Durchführung zu achten hat. Schließlich interessiert in vielen Fällen auch das Pufferungsvermögen bei der Entkälkung, denn je größer die Pufferungskapazität ist, um so weniger ist mit pH-Sprüngen bei der Durchführung des Entkälkungsprozesses zu rechnen.
Nachstehend soll über Untersuchungsmethoden zur Bestimmung des Entkälkungswertes, des pH-Wertes, der Pufferkapazität und der Kalklöslichkeitszahl von Entkälkungsmitteln berichtet werden.
1. Entkälkungswert
Plapper hat bereits 1952 über die Kennzeichnung von Entkälkungsmitteln durch potentiometrische Titration berichtet. Nach seiner Auffassung ist die Alkalititration bis zum Phenolphthaleinumschlag in vielen Fällen problematisch, wenn Gemische verschieden starker Säuren vorliegen, wenn sehr schwache Säuren vorliegen oder wenn die Entkälkungsmittel die Entkälkungssäure ganz oder teilweise in Form von Ammonsalzen enthalten, da man in diesen Fällen nichts über die Säurestärke und das Pufferungsvermögen erfahre. Nun interessieren bei der zunächst für die Beurteilung des Handelswertes wichtigen Bestimmung des Entkälkungswertes die beiden letzteren Faktoren
nicht, und die Ammonsalze kann man bekanntlich ebenfalls titrometrisch erfassen, wenn man nach dem Prinzip der Formoltitration den Ammoniumanteil durch Zusatz von Formaldehyd in Hexamethylentetramin überführt und damit die an Ammonium gebundene Säure in Freiheit setzt.
Tabelle 1:
Der Entkälkungswert soll nur der Wertbestimmung dienen, um das zu untersuchende Produkt hinsichtlich Einsatzhöhe und Preis mit anderen Entkälkungsprodukten vergleichen zu können, und in diesen Fällen genügt eine einfache Titration gegen Phenolphthalein, zumal dessen Umschlagbereich von pH 8,9-9,8 an seiner unteren Grenze in dem pH-Bereich liegt, in dem sich zumeist auch die Endstadien des Entkälkungsprozesses etwa abspielen. Der Entkälkungswert gibt an, welche Menge des betreffenden Entkälkungsmittels benötigt wird, um 1g Ca(OH)2 zu neutralisieren. Zu seiner Bestimmung wird zweckmäßig das folgende Verfahren verwendet:
1 g des Entkälkungsmittels wird in 100 ml destilliertem Wasser gelöst, 15 ml 35 %igen Formaldehyds, der vorher gegen Phenolphthalein neutralisiert wurde, werden zugesetzt und dann wird mit n-NaOH gegen Phenolphthalein bis zur bleibenden Rötung titriert. Werden dabei x ml n-NaOH verbraucht, so erfolgt die Berechnung des Entkälkungswertes nach folgenden Überlegungen:
1 000 ml n-Alkalilösung entsprechen 37g Ca(OH)2 1g Ca(OH)2 benötigt also zur Neutralisation
- 1000 : 37 = 27 ml n-Alkalilösung
- 1g Entkälkungsmittel benötigt zur Neutralisation x ml NaOH
- 1g Entkälkungsmittel entspricht x : 27g Ca(OH)2
- 1g Ca(OH)2 benötigt 27 : x g Entkälkungsmittel (= Entkälkungswert).
Tabelle 1 gibt im oberen Teil für eine Reihe technischer Säuren und Ammonsalze den Verbrauch an n-NaOH nach der mitgeteilten Durchführungsvorschrift und die aus diesen Titrationsergebnissen sich errechnenden Entkälkungswerte wieder. Im unteren Teil der Tabelle sind die entsprechenden Werte für 17 handelsübliche Entkälkungsmittel enthalten. Die Werte zeigen, in welch außerordentlich starkem Maße der Entkälkungswert schwanken kann. Wenn z. B. bei Produkt 4 nur 1,79 g zur Neutralisation von 1 g Ca(OH)2 benötigt werden, während bei Produkt 1 5,37 g, bei Produkt 10 11,44 g und bei Produkt 6 sogar 22,5 g erforderlich sind, um den gleichen Effekt zu erreichen, so machen diese Daten deutlich, daß man den preislichen Wert eines Entkälkungsmittels nur beurteilen kann, wenn man diese Zahlen berücksichtigt, und daß das Produkt 4 bei höherem Preis unter Umständen für die Praxis doch billiger sein kann als die Produkte 1, 10 und 6. Außerdem geben diese Zahlen dem Praktiker auch Anhaltspunkte dafür, in welchem Mengenverhältnis man die verschiedenen Entkälkungsmittel gegeneinander austauschen muß, um den gleichen Neutralisationseffekt zu erhalten. Daher scheint uns der Entkälkungswert für die Praxis von besonderer Bedeutung zu sein.
2. Säurestärke und Pufferungsvermögen
Will man außerdem auch Anhaltspunkte über die Säurestärke und das Pufferungsvermögen eines Entkälkungsmittels erhalten, was aus den bereits eingangs dargelegten Gründen ebenfalls für den praktischen Einsatz zweckmäßig sein kann, so empfiehlt sich, entweder nach dem Vorschlag von Plapper mittels potentiometrischer Titration den Verlauf der Titrationskurven im pH-Bereich von 2-11 aufzunehmen oder einfacher elektrometrisch auf verschiedene pH-Werte im alkalischen Bereich zu titrieren und die Höhe der Differenz des Alkaliverbrauchs für die einzelnen pH-Stufen als Maß für das Pufferungsvermögen zugrunde zu legen. Dabei können aber nicht einfach gleiche Gewichtsmengen der verschiedenen Entkälkungsprodukte verglichen werden, da diese ja unterschiedliche Entkälkungswerte besitzen und daher auch in unterschiedlicher Menge für den gleichen Entkälkungseffekt verwendet werden müssen, sondern man muß jeweils Mengen mit gleichem Entkälkungswert zugrunde legen. Die Bestimmung der Säurestärke und des Pufferungswertes wird wie folgt durchgeführt:
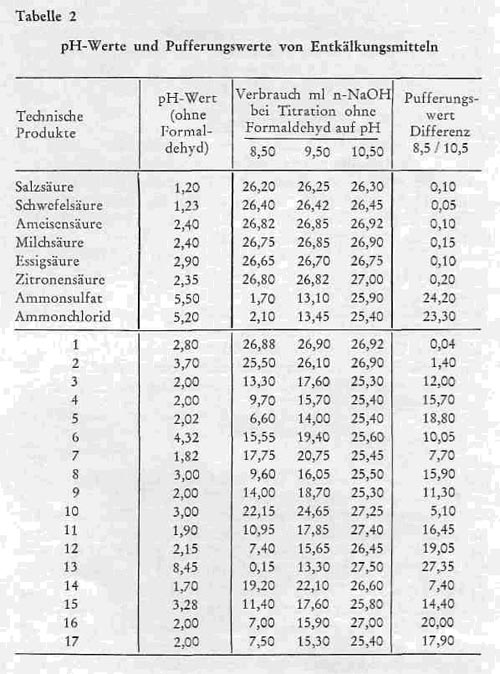
Eine Menge des zu untersuchenden Entkälkungsmittels, die zur Neutralisation von 1g Ca(OH)2 erforderlich ist (Entkälkungswert, Tabelle 1), wird in 100 ml destilliertem Wasser gelöst. Dann wird der pH-Wert dieser Lösung elektrometrisch bestimmt und anschließend mit n-NaOH auf pH 8,5, 9,5 und 10,5 titriert. Die Differenz des Verbrauches an ml n-NaOH zur Titration auf pH 8,5 und 10,5 dient als Maß für das Pufferungsvermögen (Pufferungswert).
In Tabelle 2 sind die diesbezüglichen Ergebnisse zusammengestellt. Sie zeigen zunächst bezüglich des pH-Wertes, daß die handelsüblichen Entkälkungsmittel, auch wenn man in Bezug auf die Kalkneutralisation gleiche Mengen miteinander vergleicht, eine stark unterschiedliche Säurestärke besitzen. Nur bei denjenigen Produkten, bei denen der pH-Wert über 5 liegt, kann man das Entkälkungsmittel auf einmal der Flotte zusetzen, bei den anderen Produkten muß man aus den oben dargelegten Gründen dafür sorgen, daß der pH-Wert in der Entkälkungsflotte nicht zwischenzeitlich unter 5 absinkt, gleichgültig, ob man nun die Zugabe mit modernen Dosiereinrichtungen steuert oder eine portionsweise Zugabe des Entkälkungsmittels vornimmt. Je niedriger der pH-Wert des Produktes liegt, um so mehr muß auf diesen Faktor geachtet werden. Außerdem ist aber die Gefahr des starken Absinkens gleichzeitig um so größer, je geringer der Pufferungswert des betreffenden Entkälkungsmittels ist und daher ist verständlich, daß sie bei stark wirkenden Säuren wie Salz- und Schwefelsäure weitaus am stärksten von allen untersuchten Produkten ausgeprägt ist, da diese Säuren den niedrigsten pH-Wert und zugleich auch den geringsten bzw. keinen Pufferungswert besitzen.
Tabelle 2:
Der in der letzten Spalte der Tabelle 2 angegebene Pufferungswert ist ein Maß für das Pufferungsvermögen des betreffenden Produktes. Die Pufferkapazität wird durch das Verhältnis zum Ausdruck gebracht, in welchem die zugesetzte Alkalimenge zu der dadurch hervorgerufenen pH-Änderung steht. Je geringer die Verschiebung des pH-Wertes durch gleiche Alkalizusätze, je größer also damit die benötigte Menge an n-NaOH ist, um den pH-Wert von 8,5 auf 10,5 anzuheben, desto größer ist die Pufferkapazität des entsprechenden Entkälkungsmittels, und die Werte in Tabelle 2 zeigen die außerordentlich starken Unterschiede, die auch nach dieser Richtung zwischen den verschiedenen Produkten vorhanden sind. Dabei haben bekanntlich Ammonsalze eine sehr hohe Pufferkapazität, da sie sich mit dem Kalk in der Blöße zu dem entsprechenden Kalksalz und Ammoniak umsetzen, und das letztere mit dem noch vorhandenen überschüssigen Ammonsalz ein gutes Ammoniak-Ammonsalz-Puffergemisch bildet, das, wie die Pufferungswerte für Ammonsulfat und Ammonchlorid in Tabelle 2 zeigen, eine besonders hohe Pufferkapazität besitzt. Je höher die Pufferkapazität ist, desto gleichmäßiger wird sich der pH-Verlauf bei der Entkälkung einstellen und desto langsamer wird bei stufenweisem Zusatz des Entkälkungsmittels auch der pH-Wert ins saure Gebiet hin absinken. Daher ist einem Entkälkungsmittel mit hohem Pufferungswert ohne Zweifel ein Vorteil für einen in Bezug auf den pH-Wert gleichmäßigeren Entkälkungsablauf einzuräumen.
3. Kalklöslichkeitszahl
Bei Verwendung bekannter Säuren ist die Wasserlöslichkeit der entstehenden Kalksalze bekannt. So sind in 100 ml Wasser von 20° C 74,5 g Calciumchlorid (6 H2O), 34,73 g Calciumacetat (2 H2O), 16,6 g Calciumformiat, 10,5 g Calciumlactat (5 H2O) und nur 0,298 g Calciumsulfat (wasserfrei) löslich. Bei Firmenprodukten unbekannter Zusammensetzung hat der Praktiker dagegen keinerlei Anhaltspunkte über die Löslichkeit sich bildender Kalksalze, und die in den Werbeschriften diesbezüglich gemachten Angaben sagen zumeist nichts darüber aus, ob sie nur für das Arbeiten mit langen Flotten oder auch mit kurzen Flotten gelten. Um auch für das Arbeiten in kurzer Flotte eine klare Beurteilungsgrundlage zu schaffen, die dem Praktiker ein rasches Urteil über die Eignung eines Entkälkungsmittels für diesen Sonderfall ermöglicht, haben wir in Anlehnung an eine Anregung von Plapper durch Umsetzung von gelöschtem Kalk mit dem zu prüfenden Entkälkungsmittel und Bestimmung des Kalkgehaltes in der Lösung ein Bestimmungsverfahren für die sogenannte Kalklöslichkeitszahl entwickelt. Um dabei alle Entkälkungsmittel unter einheitlichen Bedingungen vergleichen zu können, musste bei dieser Bestimmung ebenfalls der Einsatz mit gleichen Entkälkungswerten erfolgen. Die Bestimmung der Kalklöslichkeitszahl wird zweckmäßig wie folgt durchgeführt:
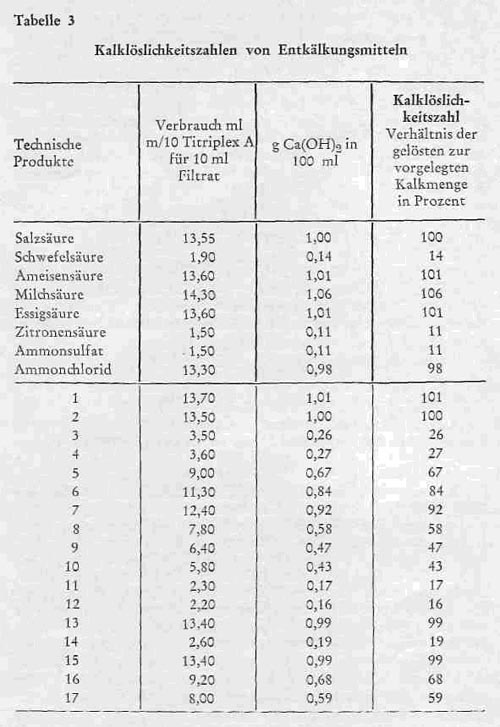
Eine Menge Kalkhydrat, die 1 g wirksames Ca(OH)2 enthält (siehe unten), wird quantitativ in eine 250 ml-Steilbrustilasche mit gut sitzendem Gummistopfen eingewogen. Von dem zu untersuchenden Entkälkungsmittel wird eine Lösung hergestellt, die in 100 ml diejenige Menge enthält, die 1 g Ca(OH)2 zu neutralisieren vermag (Entkälkungswert, Tabelle 1). Davon werden genau 100 ml mit Pipette in die Steilbrustflasche gegeben und diese sofort verschlossen. Durch leichtes Schwenken wird der Kalk aufgeschwemmt, und dann wird das Gemisch im Schüttelapparat 2 Stunden mit 40 U/Min. bewegt. Anschließend wird durch ein mittelschnell filtrierendes Filter filtriert und in einem aliquoten Teil des Filtrates der Gehalt an Calciumionen komplexometrisch bestimmt und als Ca(OH)2 berechnet. Dazu versetzt man 10 ml des Filtrats mit 1 Puffertablette (Merck), erwärmt auf 40-50° C, fügt 1 ml Ammoniak konz. hinzu und titriert mit m/10 Titriplex A-Lösung von rot nach grün. Die Titration soll im pH-Bereich um 11 erfolgen (evtl. mit Indikatorpapier prüfen). 1 ml m/10 Titriplex A-Lösung entspricht 7,4 mg Ca(OH)2. Betrug der Verbrauch an Komplexon a ml, so berechnet sich die Gesamtmenge an Kalkverbindungen im Filtrat, als Ca(OH)2 berechnet, nach der Formel
g Ca(OH)2 = a x 7,4 x 10 : 1000
Aus dem so erhaltenen Wert wird durch Multiplikation mit 100 die Kalklöslichkeitszahl errechnet, die damit das Verhältnis der wiedergefundenen zur vorgelegten Menge an Ca(OH)2 in Prozent wiedergibt.
Die Bestimmung des bei dieser Untersuchung zu verwendenden Kalkhydrates auf nutzbaren Kalk kann nach den Angaben des gerbereichemischen Taschenbuches erfolgen3) oder einfacher, indem man 1 g des zu untersuchenden Kalkes in 1 1 destilliertem Wasser löst, diese Lösung in einem geschlossenen Gefäß bei wiederholtem Umschütteln 2-3 Stunden stehen lässt, dann die Lösung sich absetzen lässt und in einem aliquoten Teil den Kalkgehalt wieder komplexometrisch bestimmt (s. o.). Im Falle unserer Untersuchungen mussten wir, um 1 g wirksames Ca(OH)2 vorzulegen, eine Menge von 1,10 g des verwendeten Kalkhydrates einwiegen.
In Tabelle 3 sind für die von uns untersuchten Entkälkungsprodukte jeweils der Verbrauch an Titriplex A, die sich daraus errechnete Menge an wiedergelöstem Ca(OH)2 in 100 ml des Filtrates und die Kalklöslichkeitszahl angeführt. Salzsäure, Ammoniumchlorid und organische Säuren, die lösliche Kalksalze bilden, ergeben Kalklöslichkeitszahlen von 95-100, bei Schwefelsäure oder Ammoniumsulfat, die schwer lösliches Calciumsulfat bilden, liegen sie dagegen bei 11-14. In diesen Grenzen von etwa 10 bis 100 lassen sich alle Entkälkungsmittel nach der Löslichkeit ihrer Kalksalze eingruppieren und je höher die Kalklöslichkeitszahl ist, desto besser sind die Produkte für die Entkälkung geeignet, wenn ohne Flotte oder mit geringer Flotte gearbeitet wird. Für diesen Fall beurteilen wir Kalklöslichkeitszahlen von 80 bis 100 als gut, Werte zwischen 50 und 80 als ausreichend, während sich bei niedrigen Kalklöslichkeitszahlen schon Bedenken ergeben, daß diese Entkälkungsmittel unter Umständen bei Verwendung ohne Flotte oder bei kurzer Flotte zu den eingangs dieses Aufsatzes geschilderten Schwierigkeiten Veranlassung geben können.
Tabelle 3:
4. Zusammenfassung
Zur Bewertung und zum preislichen Vergleich von Entkälkungsmitteln sind 4 Kennzahlen für die Praxis von Wert:
- der Entkälkungswert, der darüber Auskunft gibt, welche Menge eines Entkälkungsmittels zur Neutralisation von 1 g Ca(OH)2 benötigt wird, und in welchem Mengenverhältnis man die verschiedenen Entkälkungsmittel gegeneinander austauschen kann;
- der p H - Wert als Maß für die Säurestärke, woraus die Art der Dosierung abgeleitet werden kann, da der pH-Wert in der Entkälkungsflotte auch nicht zwischenzeitlich unter 5 absinken sollte;
- der Pufferungswert als Maß für die Pufferkapazität des Entkälkungsmittels. Je besser diese, um so gleichmäßiger wird sich der pH-Verlauf bei der Entkälkung einstellen und um so weniger ist bei stufenweiser Dosierung mit pH-Sprüngen zu rechnen;
- die Kalklöslichkeitszahl als Maß für die Wasserlöslichkeit der sich bei der Entkälkung bildenden Kalksalze. Sie gibt an, wie viel Prozent des sich bildenden Kalksalzes unter den gewählten Bedingungen in Wasser löslich sind.
Für die Bestimmung dieser Werte werden Analysenvorschriften mitgeteilt und Angaben für die Auswertung der erhaltenen Befunde gemacht.
Wir danken dem Wirtschaftsministerium des Landes Nordrhein-Westfalen herzlich für die finanzielle Unterstützung dieser Untersuchungen. Weiter sind wir Herrn Dr. Joh. Otto für zahlreiche Anregungen bei der Durchführung der Untersuchungen und der Auswertung der Ergebnisse besonders dankbar.
Literaturverzeichnis
- H. Herfeld, E. Häußermann und St. Moll, Gerbereiwissenschaft und Praxis, April und Mai 1967
- J. Plapper, Das Leder 1952, 25
- A. Küntzel, Gerbereichemisches Taschenbuch, 6. Auflage Dresden und Leipzig 1955
Kategorien:
Quellenangabe:
Zitierpflicht und Verwendung / kommerzielle Nutzung
Bei der Verwendung von Inhalten aus Lederpedia.de besteht eine Zitierpflicht gemäß Lizenz CC Attribution-Share Alike 4.0 International. Informationen dazu finden Sie hier Zitierpflicht bei Verwendung von Inhalten aus Lederpedia.de. Für die kommerzielle Nutzung von Inhalten aus Lederpedia.de muss zuvor eine schriftliche Zustimmung (Anfrage via Kontaktformular) zwingend erfolgen.
www.Lederpedia.de - Lederpedia - Lederwiki - Lederlexikon
Eine freie Enzyklopädie und Informationsseite über Leder, Ledertechnik, Lederbegriffe, Lederpflege, Lederreinigung, Lederverarbeitung, Lederherstellung und Ledertechnologie