Inhaltsverzeichnis
124 Untersuchungen zum Pickelprozess aus dem Jahre 1975
Von H. Herfeld und B. Schubert
Im Anschluss an Untersuchungen über die Quellung und Prallheit tierischer Haut in Säurelösungen wird in der vorliegenden Veröffentlichung über Untersuchungen zum Pickelprozess berichtet. Dabei wird für eine ganze Reihe von Pickelsystemen mit Schwefelsäure bzw. Ameisensäure als Pickelsäure, Natriumchlorid, Natriumsulfat, Natriumformiat und Natriumacetat als Pickelsalz die Salzmenge bestimmt, die gerade ausreicht, um die Quellung zu unterdrücken, ohne negative Quellwerte zu erhalten. Es zeigt sich, dass in der Praxis vielfach zu hohe Salzmengen verwendet werden, wodurch die Fülle des Leders ungünstig beeinflusst wird. Auch hier wurden der Temperatureinfluss und der Einfluss der Flottenmenge ermittelt, und für den letzteren Fall wurde eine Formel entwickelt, die zu berechnen gestattet, welche Salzmengen bei Variation der Flottenmenge benötigt werden, um unter Berücksichtigung des Wassergehalts der Blößen jeweils gleiche Salzkonzentrationen und damit gleichen Quellungsgrad einzustellen.
In connection with investigations on the swelling and plumpness of animal skin in acid Solutions, the present paper deals with studies on pickling. In these, using a whole series of pickle Systems with sulphuric or formic acid as the pickle acid and sodium chloride, sodium sulphate, sodium formate or sodium acetate as the pickle salt. the amount of salt just necessary to supress swelling, without producing negative swelling, was determined. It was shown that in practice many times too much salt was used, thereby unfavourably affecting the fullness of the leather. Moreover, the influence of temperature and of the float volume were investigated and for the latter a formula was established which enables a calculation to be made of the amount of salt needed when the float is varied, tasking into account the water content of the pelt, to establish current dalt concentrations and hence the same degree of swelling.
H. Herfeld und B. Schubert
Untersuchungen zum Pickelprozess
Kürzlich berichteten wir über Untersuchungen über die Quellung und Prallheit tierischer Haut in Säurelösungen. Diese Untersuchungen unterschieden sich von anderen älteren Arbeiten zum gleichen Thema dadurch, dass neben der Quellung der Haut auch die Prallheit, d. h. die gegenseitige Verspannung der Fasern im dreidimensionalen Fasergeflecht zahlenmäßig ermittelt wurde und dass die Bestimmung der Werte an strukturierter Haut nicht indirekt durch die Erfassung der die Quellung begleitenden Wasseraufnahme erfolgte, sondern direkt vorgenommen wurde, und zwar die Quellung durch Messung der Dickenzunahme der Haut, die Prallheit durch Ermittlung der Verminderung der Kompressibilität. Wir haben im Rahmen dieser Untersuchungen das Verhalten der Haut hinsichtlich Quellung und Prallheit in Lösungen von Mineralsäuren, organischen Säuren und sogenannten nichtquellenden Säuren ermittelt, wobei sich insbesondere aus dem Verhältnis von Quellung und Prallheit Folgerungen bezüglich der Dissoziation der gebildeten Kollagensalze, der mechanischen Beanspruchung des Fasergefüges im sauren und alkalischen Bereich, der Auswirkung des hydrotropen Verhaltens organischer Säuren und insbesondere auch der Gefährlichkeit der Säureprallheit im Vergleich zur Alkaliprallheit ergaben. Wir haben ferner den Temperatureinfluss und den Einfluss der Flottenmenge auf Quellung und Prallheit festgestellt und im Anschluss an die letztere Feststellung ein Pickelverfahren mit an sich quellend wirkenden Säuren ,,ohne Salz„ mitgeteilt, bei dem zwar die Pickelwirkung des Alkalisulfatgehaltes des Chromsalzes ausgenutzt, auf einen besonderen Kochsalzzusatz aber völlig verzichtet wird. Es lag auf der Hand, dass sich weitere Untersuchungen in gleicher Richtung auch mit dem Pickelprozess befassen mussten, um auch hier direkt zahlenmäßig zu erfassen, wie sich zunehmende Salzzusätze auf die Verminderung von Quellung und Prallheit auswirken.
Pickel sind bekanntlich Säure-Salz-Gemische, bei denen das Neutralsalz die Aufgabe hat, die quellende Wirkung der Säure je nach Art und Menge mehr oder weniger stark herabzusetzen, völlig aufzuheben oder sogar bei sehr hohen Salzkonzentrationen unter den Wert reiner Wasserquellung zu vermindern. Die Säureaufnahme erfolgt aus solchen Gemischen weitgehend unabhängig vom Salzgehalt, ihre maximale Bindung an die Hautsubstanz unter Bildung der entsprechenden Proteinsalze ist ein stöchiometrischer Vorgang und daher nur vom Säureäquivalent der Haut abhängig. Daneben können natürlich auch weitere Säuremengen kapillar aufgenommen werden. Das Pickelvolumen spielt für die Bindung der Säure keine Rolle, und wenn bei Kurzzeitpickeln häufig gesteigerte Säuremengen eingesetzt werden, so nur, um die Diffusion in die Haut zu beschleunigen. Aus Pickelgemischen wird nicht nur die beim Pickelansatz verwendete, sondern auch die durch doppelte Umsetzung von Säure und Salz entstehende Säure, wenn das Anion des Pickelsalzes ein anderes ist als das der Pickelsäure, in dem durch die jeweiligen Affinitätsverhältnisse gegebenen Maße von der Haut aufgenommen und gebunden, aus einem Schwefelsäure-Natriumformiat-Pickel wird also nicht nur Schwefelsäure, sondern auch Ameisensäure gebunden.
Die Salzaufnahme erfolgt unabhängig von der Säure nur kapillar proportional der Salzkonzentration. Die die Säurequellung hemmende Wirkung beruht auf der Zurückdrängung der Dissoziation des gebildeten Proteinsalzes (Gegenionenwirkung) z. B.
[Kollagenchlorid] ↔ [Kollagen+] + [Cl-]
und ist damit nach dem Massenwirkungsgesetz, unabhängig vom Äquivalenzverhältnis Säure zu Salz, nur von der absoluten Salzkonzentration abhängig. In den Lehrbüchern wird allgemein angeführt, dass zur Vermeidung einer Säurequellung auch bei höheren Säurekonzentrationen im Pickel mindestens 5% Salz vom Pickelvolumen erforderlich sind. In der Praxis werden vorwiegend Schwefelsäure-Kochsalz-Pickel verwendet, doch können selbstverständlich auch andere Säuren und andere Salze eingesetzt werden und da die verschiedenen Säuren unterschiedliches Quellvermögen besitzen, die verschiedenen Salze andererseits unterschiedlich stark quellungshemmend wirken können, müssen sich je nach der Kombination unterschiedliche Wirkungen ergeben.
Auch über den Pickelprozess liegen bereits umfangreiche Untersuchungen vor, doch kann hier auf die zusammenfassenden Darstellungen in den gerbereichemischen Fachbüchern verwiesen werden. Auf die Gesetzmäßigkeiten der Säureaufnahme und -bindung und der Salzaufnahme soll hier nicht weiter eingegangen werden. Dagegen haben wir uns erneut mit den Quellungserscheinungen in Pickelgemischen beschäftigt, da bei allen bisher vorliegenden Untersuchungen die Prallheit unberücksichtigt blieb und die Quellungserscheinungen nicht direkt ermittelt wurden, sondern wieder nur über die Aufnahme oder Abgabe von Wasser, obwohl in die Gewichtsveränderung gleichzeitig auch die meist nicht berücksichtigte Chemikalienaufnahme mit eingeht. Wir haben dagegen bei unseren Untersuchungen wieder die Quellung und Prallheit direkt zahlenmäßig bestimmt, die Quellung durch Bestimmung der Stärkezunahme, die Prallheit durch Ermittlung der Verminderung der Kompressibilität. Auf die Methodik dieser Messungen soll hier nicht weiter eingegangen werden, sie kann in früheren Untersuchungen nachgelesen werden3, und ebenso gelten auch bezüglich des Versuchsansatzes die in der vorhergehenden Arbeit gemachten Ausführungen. Die Untersuchungen wurden also wieder mit Kalbsblößen durchgeführt, die Flottenmenge betrug normalerweise 200% auf Blößengewicht, die meisten Versuche erfolgten bei 25°C und 24 Stunden Einwirkungsdauer, um reproduzierbare Endwerte zu erhalten. Soweit Abweichungen vorgenommen wurden, ist dies bei Behandlung der Untersuchungen ausdrücklich vermerkt.
I. Einfluss verschiedener Salze auf die Quellung und Prallheit tierischer Haut in Säurelösungen
In der Praxis werden für den Pickelprozess vorwiegend Schwefelsäure und Ameisensäure oder auch ein Gemisch beider Säuren als Säurekomponente, normalerweise Kochsalz als Salzkomponente verwendet. Wie die Werte in Tabelle.1 zeigen, hat Kochsalz für sich im niederen Konzentrationsbereich eine gewisse quellende Wirkung (Neutralsalzquellung im Vergleich zur reinen Wasserquellung), die dann mit zunehmender Konzentration wieder zurückgeht und bei Konzentrationen von etwa 15% aufwärts in eine entquellende Wirkung umschlägt (siehe auch Küntzel). In der Praxis liegt die Salzkonzentration in Pickelgemischen meist zwischen 5 und 10%, die Quellungswerte zwischen 2,3 und 1,6 sind also sehr niedrig.
| Konzentration der NaCl-Lösung in % | Quellungswert |
| 0 | 0 |
| 1 | 0,69 |
| 2,5 | 1,35 |
| 5 | 2,32 |
| 7,5 | 1,96 |
| 10 | 1,62 |
| 15 | 0 |
| 20 | -0,8 |
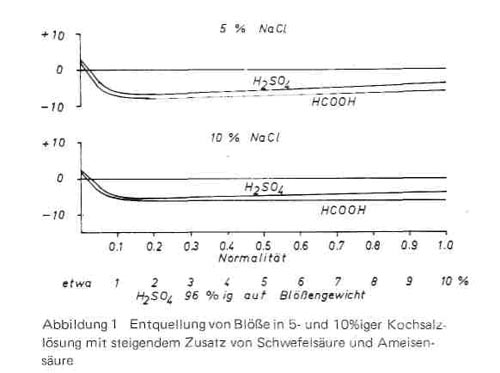
Setzt man zu diesen Lösungen steigende Mengen an Säuren zu, so tritt, wie die Kurven in Bild 1 zeigen, eine zusätzliche Entquellung ein, die unabhängig von der Salzkonzentration bei etwa 0,1-0,15 Normalität ein Minimum erreicht und mit steigender Säurekonzentration dann wieder etwas abnimmt. dass nicht nur Salz die Säurequellung zurückdrängt, sondern auch Säuren die Salzquellung hemmen können, wurde schon von Küntzel beobachtet. Das Auftreten negativer Werte zeigt, dass in diesem Bereich eine effektive Entwässerung des Hautmaterials stattfindet, der dadurch bewirkte Entquellungseffekt ist bei Ameisensäure etwas stärker als bei Schwefelsäure. Für die Praxis interessieren nur die ersten Werte der Kurven, da in den Pickeln der Lederindustrie der Säuregehalt zwischen 1-1,5% auf Blößengewicht schwankt und im Konservierungspickel bis zu 2, unter Umständen bis zu 2,5% bei 100% Flotte ansteigt. Nur bei Petzpickein werden erheblich höhere Säuremengen verwendet, die die 4-8fache Menge der Konzentration in Gerbpickeln, auf Zentrifugiergewicht bezogen, betragen.
Bild 1
Das Auftreten von Entquellungen der Haut bzw. der Blöße in Pickeln unter den Grad der Wasserquellung ist zumindest beim Pickeln vor der Chromgerbung sehr unerwünscht, da dadurch bei der nachfolgenden Gerbung einmal die Diffusion der Chromsalze in die Haut und damit die Gerbgeschwindigkeit vermindert und zum anderen der entquollene Zustand des Fasergefüges festgegerbt wird und damit flache und leere Leder erhalten werden. Ist andererseits die Quellung zu stark, die Salzmenge also nicht genügend groß, so werden die Leder zu fest und es kann ein Narbenplatzen auftreten. Man ist daher bestrebt, bei der Sauerstellung der Haut vor der Chromgerbung zwar eine zu starke Säurequellung zu vermeiden, aber doch eine gewisse Restquellung bestehen zu lassen (um so mehr, je ständiger das herzustellende Leder sein soll), eine Entquellung unter den Wasserwert (negative Werte) aber auf alle Fälle zu vermeiden. Für die durchzuführenden Untersuchungen ergaben sich damit 3 Fragen:
1.Welche Mengen an Salz sind in den verschiedenen Pickelsystemen erforderlich, um die Säurequellung genügend zu vermeiden, andererseits aber nicht in den Bereich stärkerer Entwässerung des Hautmaterials zu kommen? Die Tendenz in der Praxis, mit möglichst geringen Salzmengen auszukommen, ist aus den dargelegten Gründen verständlich.
2.Wie ist die erforderliche Salzmenge von der Art der Pickelsäure und von der Art des zugefügten Salzes abhängig?
3.Wirkt sich die entquellende Wirkung mit zunehmen der Salzkonzentration in gleicher Intensität auf Quellung und Prallheit aus?
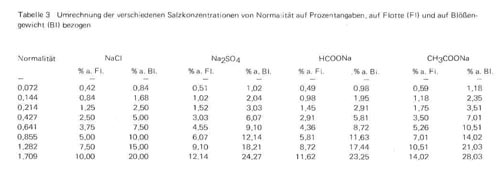
Zur Beantwortung dieser Fragen wurden entsprechende Versuchsreihen mit 1 und 2% Schwefelsäure und mit äquivalenten Mengen Ameisensäure (0,94 bzw. 1,88% 100%ige Säure) durchgeführt und steigende Mengen Kochsalz, Natriumsulfat, Natriumformiat und Natriumacetat, ansteigend von 0,072 bis zu 1, 709 Normalität zugesetzt. Die erhaltenen Werte für Quellung und Prallheit sind in Tabelle 2 zusammengestellt. Tabelle 3 gibt für die verschiedenen Salze die Umrechnung von Normalität auf absolute Gewichte wieder, auf Flottenmenge und auf Blößengewicht bezogen, und stellt damit für den Praktiker die Beziehungen zu den in der Praxis üblichen Pickelangaben her.
a) 1% Schwefelsäure + verschiedene Salze.Die letzte der 3 oben genannten Fragen ist am leichtesten zu beantworten, mitzunehmendem Salzzusatz nehmen die Prallheitswerte bei allen Salzen wesentlich stärker ab als die Quellwerte. So beträgt z. B. bei 0,072 Normalität bei Kochsalz der Quellwert 62,7%, der Prallheitswert 46,1% der Werte in reinen Säurelösungen, bei 0,072 Normalität Natriumformiat betragen die entsprechenden Werte 27,5 bzw. 12,8%. Das ist nicht verwunderlich, denn die Prallheit, d. h. die Verspannung der Fasern gegeneinander im dreidimensionalen Fasergeflecht tritt mit fortschreitender Quellung erst stärker ein, wenn keine nennenswerte Dickenzunahme mehr möglich ist, und daher muss auch bei dem gegenteiligen Vorgang der Entquellung die Verspannung rascher zurückgehen und verschwinden als die eigentliche Quellung.
Tabelle 1
Wir hatten in der vorhergehenden Veröffentlichung1 zeigen können, dass im sauren Gebiet im Gegensatz zur Alkaliquellung die Werte für die Prallheit höher liegen als für die Quellung und daraus gefolgert, dass die Proteinsalze im sauren Gebiet stärker dissoziiert sind als im alkalischen Bereich, was zwangsläufig zu einer stärkeren Abstoßung durch gleichsinnige Aufladung und damit zu einer besonders starken gegenseitigen Verspannung der Fasern im Fasergeflecht führt. Mit zunehmendem Salzzusatz liegen aber schon bei 0,072 Salznormalität der Lösung die Prallheitswerte wieder niedriger als die eigentlichen Quellwerte und diese Relation bleibt auch bei weiteren Salzzusätzen bestehen.
Die die Quellung der Haut vermindernde Wirkung des Salzzusatzes ist bei den 4 vergleichsweise geprüften Salzen unterschiedlich stark ausgeprägt und nimmt in der Reihenfolge Kochsalz, Natriumsulfat, Natriumformiat und Natriumacetat zu. Das in der Praxis meist verwendete Kochsalz ist also am wenigsten wirksam, der Bereich, in dem die Quellung in die negative Entquellung übergeht (Quellung geringer als Wasserquellung), liegt zwischen 0,214 und 0,427 Normalität = 2,5-5% auf Blößengewicht bei 200% Wasser. Wenn in den Lehrbüchern angeführt wird, dass zur Vermeidung einer Säurequellung eine Kochsalzkonzentration von mindestens 5% erforderlich sei und auch in der Praxis die Salzlösung meist auf 5° Be vor Säurezugabe eingestellt wird, so ist das nach dem Ergebnis dieser Untersuchungen nicht richtig, insbesondere dann nicht, wenn geringere Flottenmengen verwendet werden, und man kann in vielen Fällen mit 4% Kochsalz eine genügende Unterdrückung der Säurequellung erreichen, während bei 5% schon eine gewisse Entquellung der Haut (flachere Leder!) eintreten kann.
Natriumsulfat bewirkt (das ist auch in der Literatur wiederholt angegeben) eine stärker quellungshemmende Wirkung als Kochsalz, wenn man gleiche Normalitäten vergleicht. Auf Weichgewicht bezogen genügen 5%, um die Quellung vollständig zu unterdrücken. Ferner zeigen die negativen Werte, dass die Gefahr, bei zu hohem Salzgehalt flache Leder zu bekommen, bei Natriumsulfat nicht so ausgeprägt ist wie bei Verwendung von Kochsalz. Diese Feststellung hat uns in neuerer Zeit wiederholt interessiert. Führt man z. B. entsprechend unseren Vorschlägen die Chromgerbung im Recycling-System durch, indem die Restbrühen immer wieder für die folgenden Partien verwendet werden, so findet
mit zunehmender Verwendung ein Austausch von Kochsalz durch Natriumsulfat statt, und man braucht selbst bei steigendem Natriumsulfatgehalt keinen nachteiligen Einfluss auf die Fülle des Leders zu befürchten. Auch beidem kürzlich von uns veröffentlichten Chromgerbverfahren mit einem „Pickel ohne Salz“ spielt dieser Faktor eine Rolle, da dabei der Alkalisulfatgehalt der Chromsalze für die Pickelwirkung ausgenutzt wird.
Tabelle 2
Noch stärker ist der entquellende Einfluss von Natriumformiat und Natriumacetat, wobei berücksichtigt werden muss, dass durch doppelte Umsetzung der Pickelkomponenten gleichzeitig Ameisensäure bzw. Essigsäure entsteht, die nicht so stark dissoziiert sind, so dass auch der pH-Wert des Pickels mit zunehmendem Salzgehalt stark ansteigt (s. u.). Bei diesen beiden Salzen genügen bereits 0,214 Normalität, d. h. bei Natriumformiat 2,9%, bei
Natriumacetat 3,5% auf Blößengewicht, um eine Quellung vollständig zu unterdrücken. Das muss stets berücksichtigt werden, wenn diese Alkalisalze organischer Säuren zum Ansatz des Pickels verwendet werden, da sonst flachere Leder erhalten werden. Man hört in Kreisen der Praxis manchmal die Auffassung, mit Natriumformiat als Pickelsalz würden die Leder flacher, was in dieser grundsätzlichen Formulierung aber falsch ist, da nur der Mengeneinsatz meist zu hoch gewählt wurde.
In der Praxis wird häufig Schwefelsäurepickeln Natrium oder Calciumformiat zugesetzt, wobei sich in doppelter Umsetzung teilweise Ameisensäure bildet und die Wirkung solcher Pickel sich derjenigen von Ameisensäurepickeln nähert. Meist wird dabei aber nicht berücksichtigt, dass die zugesetzten Formiate als Salze ebenfalls bereits als solche oder in der Form der bei der doppelten Umsetzung entstehenden Sulfate eine Pickelwirkung besitzen. Daher muss der Kochsalzgehalt um etwa den gleichen Prozentsatz vermindert werden, um der Gefahr des Erhalts flacher Leder aus dem Wege zu gehen. Arbeitet man mit geringer Flotte (s. u.) und steigert den Natriumformiatzusatz auf 2,5%, so kann sogar auf einen Kochsalzzusatz völlig verzichtet werden.
Es sei an dieser Stelle auch nochmals darauf hingewiesen, dass der entwässernde Einfluss der verschiedenen Salze bei hohen Salzeinsätzen nicht gleich intensiv ist. Allen Salzzusätzen ist in diesem Bereich gemeinsam, dass nach Erreichung eines Optimums der Entwässerung mit zunehmender Salzmenge wieder eine geringfügige Verminderung der Entquellung eintritt. Im übrigen haben Natriumchlorid und Natriumformiat in diesen Bereichen der negativen Werte die stärkste entquellende Wirkung, beim Natriumacetat und insbesondere beim Natriumsulfat ist sie geringer.
b) 0,94% Ameisensäure + verschiedene Salze.Der Ausgangsbereich ist in dieser Versuchsserie insofern von der vorhergehenden Serie unterschiedlich, als die Quellwerte und insbesondere die Prallheitswerte in reiner Säurelösung höher lagen. Diese Erscheinung hatten wir ebenfalls bereits in der vorhergehenden Veröffentlichung1 diskutiert. Die höheren Werte hängen nicht mit einer stärkeren Dissoziation der sich bildenden Proteinsalze zusammen, sondern mit der die Ladungsquellung überlagernden hydrotropen Wirkung der undissoziierten Carboxylgruppen und der dadurch stärkeren Auswirkung der elektrostatischen Abstoßung gleichgeladener Bereiche. Trotz der stark gesteigerten Prallheitswerte reichen auch hier schon verhältnismäßig geringe Salzmengen aus, um die Prallheitswerte stark herabzusetzen. So beträgt z B. auch hier bei 0,072 Normalität bei Kochsalz der Quellungswert 55%, der Prallheitswert dagegen nur noch 30 1% der Werte in reiner Säurelösung und bei 0,072 Normalität Natriumformiat betragen die entsprechenden Werte 41,6 bzw. 21,6%. Auch hier kann also die Frage 3 wieder klar dahingehend beantwortet werden, dass der Einfluss des Salzzusatzes auf die Verminderung der Prallheit wesentlich stärker als auf die Herabsetzung der Quellungswerte ausgerichtet ist.
Bezüglich der Verminderung der Quellungswerte verhalten sich auch in diesem Falle die verschiedenen Salze unterschiedlich, und man könnte die gleiche Reihenfolge annehmen, die wir oben besprachen, wenn nicht Natriumformiat im Gemisch mit Ameisensäure sich bezüglich der Verminderung der Quellung grundsätzlich ungünstiger verhielt, so dass die Quellwerte bei gleicher Salzkonzentration zwar niedriger als bei Kochsalz, aber höher als bei Natriumsulfat und Natriumacetat liegen. Man ist zunächst geneigt, das vielleicht auf eine verstärkte Hydrotropie zurückzuführen, aber dann müsste die Erscheinung bei Natriumacetat in noch verstärktem Maße auftreten, was indessen nicht der Fall ist. Vielmehr sehen wir die Ursache darin, dass dann, wenn Säure und Salz gleiches Anion besitzen, nur die Zurückdrängung der Dissoziation durch die Gegenionen, nicht aber die Bildung anderer, stärker oder schwächer dissoziierter Proteinsalze durch doppelte Umsetzung zwischen Säure und Salz für die Änderung des Quellungszustandes verantwortlich ist. Wie dem auch sei, Natriumformiat nimmt in dieser Reihe eine Sonderstellung ein.
Für die Praxis interessant ist die Feststellung, dass bei Verwendung eines Ameisensäure-Pickels mit etwa 1% Ameisensäure eine Salzmenge von 0,214 Normalität bei allen Salzen ausreicht, um die Säurequellung praktisch vollständig zu unterdrücken. Das bedeutet, auf Blößengewicht bezogen 2,5% Kochsalz, 3,0% Natriumsulfat, 2,9% Natriumformiat und 3,5% Natriumacetat. In der Praxis findet man bei Einsatz von Ameisensäure-Pickeln, dass aus alter Tradition oft 5% Kochsalz wie beim Schwefelsäurepickel eingesetzt werden. Das ist aber falsch und führt zwangsläufig zu flacheren Ledern.
Im Bereich der negativen Quellwerte treten wieder die gleichen Unterschiede wie in der ersten Serie auf. Natriumchlorid und Natriumformiat bewirken einen stärkeren Verfall der Blößen als Natriumsulfat und Natriumacetat und bei sehr hoher Steigerung der Salzzugabe erfahren die negativen Werte wieder eine gewisse Verminderung.
c)2% Schwefelsäure + verschiedene Salze. Wir haben in dieser und der folgenden Serie mit verdoppelter Säuremenge gearbeitet. An und für sich ist eine so hohe Säuremenge nicht erforderlich. Bei der Sauerstellung der Haut wird das Kollagen in die entsprechenden Salze übergeführt. Das ist ein stöchiometrischer Vorgang. Wasserfreies Kollagen hat bekanntlich ein Säureäquivalent von 1142, d. h. dass 1142 g 49 g Schwefelsäure binden. Das entspricht etwa der 4fachen Menge wasserhaltiger Blöße = ungefähr 4568 g und damit benötigt man auf Blößengewicht 1,07% Schwefelsäure. Zum Absättigen der basischen Gruppen des Kollagens werden also 1-1,1% Schwefelsäure, 0,75-0,8% Salzsäure 100%ig = 2,3-2,5% 32%iger Säure oder 0,94-1% Ameisensäure 100%ig = 1,1-1,2% 85%iger Säure benötigt. Eine weitere Steigerung der Säuremenge kann keine zusätzliche Reaktion mit der Haut bewirken. Trotzdem wird bei sogenannten Kurzzeitpickeln häufig eine höhere Säuremenge eingesetzt, um die Diffusionsgeschwindigkeit der Säure, die ja von der Konzentration abhängig ist, zu beschleunigen. Daher schien uns wichtig, zu prüfen, ob sich damit auch die Salzmenge ändert, die nötig ist, um die Quellung zu unterdrücken. Wir haben uns aber darauf beschränkt, diese Versuche mit Kochsalz und Natriumformiat durchzuführen.
Interessant ist, dass bei diesen Versuchsreihen die die Quellung und Prallheit unterdrückende Wirkung beim Kochsalz wesentlich langsamer anspringt als bei Natriumformiat. Im letzteren Falle wurde mit 0,072 Normalität die Quellung auf 63,2%, die Prallheit auf 51,3% vermindert, also nicht so stark wie bei gleichem Formiatzusatz zu 1 %iger Schwefelsäurelösung, aber doch sehr beträchtlich. Zur völligen Unterdrückung der Quellung wird ein Formiatzusatz von 0,214-0,427 Normalität = 2,9-5,8% auf Blößengewicht, also rund ein 5%iger Natriumformiat-Zusatz benötigt. Bei Kochsalzzusatz dagegen erreicht man mit 0,072 Normalität des Salzzusatzes praktisch noch keine Verminderung der Quellung und Prallheit, bei 0,144 Normalität beträgt die Quellung noch 89,1%, die Prallheit noch 73,8% der Werte der reinen Säurelösung. Zur völligen Unterdrückung der Quellung wird eine Salznormalität von 0,641 = 7,5% auf Biößengewicht benötigt. Diese Zunahme der benötigten Salze bei Steigerung der Säuremenge im Pickel, um den gleichen Grad der Unterdrückung der Quellung zu erreichen, wird sicherlich in der Praxis auch nicht genügend beachtet.
d)1,88% Ameisensäure + verschiedene Salze. Bei dieser Reihe haben sich keine Besonderheiten ergeben. Natürlich geht auch bei den von Haus aus hohen Quellungs- und Prallheitswerten deren Unterdrückung etwas langsamer vor sich, und für die restliche Unterdrückung werden knapp 0,427normale Lösungen, also 4,5% Kochsalz bzw. 5% Natriumformiat auf Blößengewicht benötigt, aber sonst haben sich keinerlei Besonderheiten gegenüber den anderen Reihen ergeben.
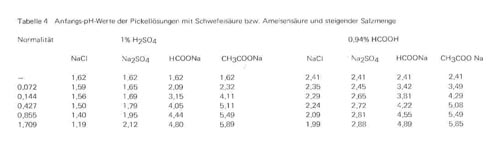
e)Anfangs-pH-Werte der Pickellösungen. Wir haben selbstverständlich bei unseren Untersuchungen auch die pH-Werte der Lösungen vor und nach der Beendigung des Pickelprozesses bestimmt. Aus dem umfangreichen Zahlenmaterial haben wir in Tabelle 4 einige pH-Werte der Pickellösungen mit 1% Schwefelsäure bzw. 0,94% Ameisensäure und steigenden Mengen der 4 verschiedenen Salze zusammengestellt, weil sie gewisse interessante Rückschlüsse zulassen.
1. Die Werte zeigen deutlich die Wechselwirkungen zwischen den lonenpaaren. Durch Zusatz von Salzen organischer Säuren steigt der pH-Wert an, einmal weil diese Salze von Haus aus mehr oder weniger alkalisch reagieren, zum anderen aber auch, weil mit zunehmendem Salzzusatz durch doppelte Umsetzung anstelle der weit1 gehend dissoziierten Schwefelsäure nur teilweise dissoziierte organische Säuren entstehen. Es wird daher auch verständlich, dass in solchen Mischungen nicht nur Kollagensulfat, sondern auch die Kollagensalze der organischen Säuren gebildet werden. Auch durch Zusatz von Natriumsulfat wird der pH-Wert der Pickellösung etwas gesteigert, wenn natürlich auch wesentlich geringer als mit organischen Säuren. Durch Zusatz von Kochsalz wird dagegen grundsätzlich der pH-Wert der Säurelösungen gesenkt. Auf die Tatsache, dass Kochsalz bei größerem Zusatz die Azidität der Lösung sowohl bei anderen starken anorganischen wie bei schwach dissoziierten organische Säuren erhöht, ist in der älteren Literatur mehrfach hingewiesen worden, und diese Tatsache hängt wohl auch hier mit der Wechselwirkung der beteiligten Ionen zusammen.
Tabelle 3
2. Aus den pH-Werten von Säure- und Pickel-Lösungen kann grundsätzlich nicht auf die Stärke der Quellwirkung geschlossen werden. Schon in der vorhergehenden Veröffentlichung konnten wir zeigen, dass organische Säuren bei höheren Konzentrationen stärker quellend und prallmachend wirken als Mineralsäuren, obwohl ihre Lösungen sicherlich einen höheren pH-Wert aufweisen. Besonders deutlich wird diese Tatsache auch aus den Werten der Tabelle 4 für das Pickelgemisch H2SO4/ NaCI, bei dem mit steigendem Kochsalzzusatz der Anfangs-pH-Wert der Lösung sinkt (Tabelle 4), die Quellung aber infolge der Gegenionenwirkung stark zurückgeht (Tabelle 2). Für den Grad der Quellung und Prallheit ist vielmehr ausschließlich die Art der gebildeten Proteinsalze und die Stärke ihrer Dissoziation, die Zurückdrängung dieser Dissoziation durch gleichzeitig vorhandene Gegenionen (Verminderung der Quellung und Prallheit z. B. durch Salzwirkung) oder die Aufhebung von Wasserstoffbrücken zwischen benachbarten Polypeptidketten durch hydrotrop wirkende Stoffe (Steigerung der Quellung und Prallheit z. B. durch undissoziierte Carboxylgruppen) maßgebend. Der pH-Wert der Pickellösungen ist dagegen völlig belanglos, seine Bestimmung bei automatischer Überwachung der Gerbvorgänge kann für die Kontrolle des Ablaufs des Pickelprozesses und der Säureaufnahme (im Vergleich mit Normalkurven für die gleiche Rezeptur) interessant sein, über die Quellwirkung der Pickelsäure bzw. die quellungs-vermindernde Wirkung der Pickelsalze sagt er aber nichts aus.
II. Einfluss der Temperatur auf Quellung und Prallheit tierischer Haut in Pickellösungen
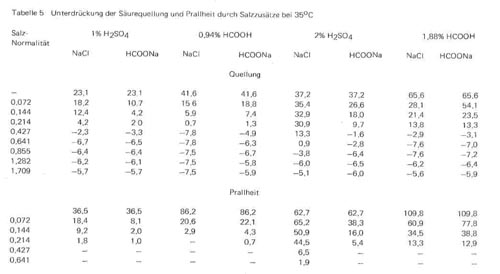
Es ist bekannt, dass bei Gerbpickeln vor der Chromgerbung Temperaturen über 25° vermieden werden sollten, da höhere Temperaturen die Gefahr des Entstehens losnarbiger und adriger Leder verstärken. Trotzdem werden gelegentlich höhere Temperaturen verwendet, um das Durchpickeln zu beschleunigen,und bei Konservierungspickeln lassen sich auf dem Transportweg der gepickelten Blößen höhere Temperaturen oft nicht vermeiden. Wir haben daher auch einige Versuchsreihen mit Schwefelsäure und Ameisensäure als Pickelsäuren und Natriumchlorid und Natriumformiat als Pickelsalze bei 35°C durchgeführt, um den Temperatureinfluss auf Quellung und Prallheit der Haut in gepickelten Systemen im Vergleich zu den Werten bei 25°C festzustellen. Die Werte sind in Tabelle 5 zusammengestellt und mit den entsprechenden Werten in Tabelle 2 in Vergleich zu setzen.
Tabelle 4
Es ist bekannt, dass bei Einwirkung von Säuren und Alkalien auf tierische Haut der Grad der Quellung bei Temperatursteigerung abnimmt. Wir haben aber in der vorhergehenden Veröffentlichung bereits festgestellt, dass diese Gesetzmäßigkeit im sauren Gebiet nur für den Einfluss von Mineralsäuren gilt, während mit organischen Säuren bei höheren Säurekonzentrationen im Gegensatz dazu bei höheren Temperaturen eine Steigerung der Quellung und insbesondere der Prallheit erfolgt, was ohne Zweifel in erster Linie mit dem hohen Temperaturfaktor der hydrotropen Wirkung der undissoziierten Carboxylgruppen in Verbindung mit einer durch Temperaturerhöhung auftretenden Verstärkung der Dissoziation der Kollagensalze zusammenhängt. Diese Gesetzmäßigkeiten treten beim Vergleich der Werte der Tabelle 2 und 5 bei den Nullwerten ohne Salzzusatz ebenfalls wieder hervor, im Falle des Einsatzes von Schwefelsäure liegen die Nullwerte für die Quellung und Prallheit bei 35°C niedriger, im Falle der Verwendung von Ameisensäure höher als bei 25°C.
Im übrigen gelten bei den Werten in Tabelle 5 für alle Systeme die gleichen Gesetzmäßigkeiten, die wir im vorhergehenden Abschnitt besprochen haben. Ganz allgemein ist der Temperatureinfluss auf die Quellung und Prallheit bei den Pickelsystemen relativ gering und entsprechend können auch die Mengen der verschiedenen Salze, die bei 25°C für eine völlige Unterdrückung der Quellung zweckmäßig sind, in gleicher Weise für 35°C übernommen werden. Interessant ist indessen die Feststellung, dass in allen Fällen, in denen Kochsalz als Pickelsalz eingesetzt wurde, die Quell- und Prallheitswerte bei 35°C etwas niedriger liegen als bei 25°C, während umgekehrt in allen Fällen, in denen Natriumformiat als Pickelsalz verwendet wurde, die Werte bei 35°C etwas höher liegen als die entsprechenden Werte bei 25°C. Dieser Einfluss ist nicht sehr stark ausgeprägt, aber er spricht dafür, dass auch durch den Natriumformiatzusatz zusätzlich bei 35°C eine gewisse hydrotrope Wirkung auftreten kann, eine Feststellung, die ebenfalls dafür spricht, bei Pickelprozessen die Temperatur möglichst nicht über 25°C zu steigern.
III. Einfluss des Flottenvolumens bei Pickelsystemen
Das Pickelvolumen kann in weiten Grenzen variieren. Bei den klassischen Gleichgewichtspickeln wird im Fass meist mit 100-150%, in Haspelgeschirren mit 250-300% Flotte auf Blößengewicht gearbeitet und bei Pelzpickeln werden sogar Mengen zwischen 500 und 1000% vom Zentrifugiergewicht je nach Art des verarbeiteten Hautmaterials eingesetzt. Bei modernen Kurzpickeln werden dagegen Wassermengen zwischen 35-70% verwendet. Es ist bekannt, dass das Pickelvolumen für die Säureaufnahme eine nur relativ geringe, für die maximale Säurebindung als stöchiometrischem Vorgang keine Rolle spielt. Wohl aber ist die Salzmenge vom Pickelvolumen abhängig, da die Gegenionenwirkung und damit die Unterdrückung der Quellung und Prallheit nach dem Massenwirkungsgesetz eine Funktion der Salzkonzentration ist. Daher waren nochmals Untersuchungen über den Einfluss des Flottenvolumens auf die Zusammensetzung des Pickels zur Erreichung einer gleichartigen Unterdrückung von Quellung und Prallheit durchzuführen.
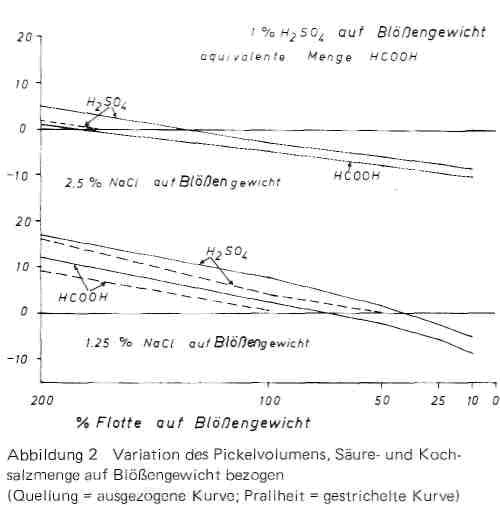
Bei unseren Versuchsansätzen haben wir als Säure wieder 1% Schwefelsäure und die äquivalente Menge Ameisensäure eingesetzt, als Salzmenge 1,25 bzw. 2,5% Kochsalz auf Blößengewicht, also Salzmengen, mit denen bei normalen Gleichgewichtspickeln die Säurequellung noch nicht restlos unterdrückt wird, so dass sich der Einfluss des Flottenvolumens auf Quellung und Prallheit deutlich bemerkbar machen musste. In der Tat zeigen die Kurven in Bild 2, dass mit abnehmender Flottenmenge Quellung und Prallheit vermindert werden, wobei bei niederen Wassermengen sogar negative Quellwerte auftreten, also eine Entwässerung des Hautmaterials erfolgt. Die in der vorhergehenden Veröffentlichung für reine Säurelösungen getroffene Feststellung, dass durch Reduzierung der Flottenmenge eine Verminderung der Dissoziation und damit der gleichartigen Aufladung der Haut statt fände, trifft hier nicht zu, da in Pickellösungen durch die Gegenionenwirkung die Aufladung bereits weitgehend unterdrückt ist. Auch eine bei Flottenmengen unter 50-60% im sauren und alkalischen Gebiet aus Wassermangel eintretende stärkere Verminderung der Quellung und Prallheit hat nie zu negativen Werten geführt. Die starke Verminderung der Quellung bis zu negativen Werten ist in Pickelsystemen bei konstanter Pickelsalzmenge (auf Blößengewicht bezogen) vielmehr in erster Linie darauf zurückzuführen, dass mit abnehmender Flottenmenge die Salzkonzentration und damit die entauellende und schließlich entwässernde Wirkung des Salzes stark ansteigt. Wird dieser Zustand anschließend festgegerbt, so entstehen relativ flache und leere Leder und häufig wird in der Praxis diese Erscheinung den Kurzpickeln als solchen zur Last gelegt, obwohl sie lediglich darauf zurückzuführen ist, dass man nicht beachtet, dass beim Übergang vom Gleichgewichtspicke! mit langer Flotte zum Kurzflottenpickel nicht nur die Flotte, sondern auch die Salzmenge entsprechend herabgesetzt werden muss.
Bild 2
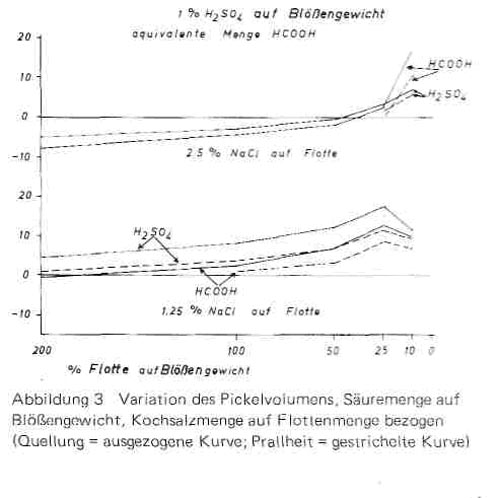
Wenn also die Salzkonzentration konstant gehalten wird, müsste nach dem Massenwirkungsgesetz auch die Gegenionenwirkung und damit der Grad der Quellung konstant bleiben. Entsprechend haben wir in weiteren Versuchsreihen zwar die Säuremenge wie bisher auf Blößengewicht, die Salzmenge dagegen auf Flottenmenge bezogen, die Salzkonzentration damit konstant eingestellt. Die Annahme, Quellung und Prallheit würden nun bei allen Konzentrationen konstant sein, hat sich indessen, wie die Werte in Bild 3 zeigen, nicht bestätigt.Jetzt war vielmehr umgekehrt bei der größten Flotte die geringste Quellung vorhanden und sie nahm in dem Maße zu, wie die Flottenmenge abnahm, um schließlich bei sehr geringer Wassermenge aus Mangel an Flüssigkeit teilweise wieder abzunehmen. Diese Feststellung gilt nicht nur für Kochsalz als Pickelsalz. Aus der Vielzahl unserer Untersuchungen sind in Bild 4 die entsprechenden Kurven für die äquivalente Menge Natriumformiat (1,45% statt 1,25% Kochsalz) als Pickelsalz angeführt. Auch hier fallen die Quellungskurven mit Abnahme der Flottenmenge ab, wenn die Salzmenge auf Blößengewicht konstant gehalten wird, sie steigen dagegen an, wenn sie auf Flottenmenge konstant eingestellt ist.
Die letztere Feststellung wird aber verständlich, wenn man berücksichtigt, dass beim Pickel neben der zugegebenen Wassermenge auch die in der Blöße befindliche Wassermenge berücksichtigt werden muss, um die tatsächlich vorliegende Kochsalzkonzentration zu beurteilen.
Bild 3
Die in der Praxis übliche Regel, dass bei Änderung des Pickelvolumens auch die Salzmenge im gleichen Prozentsatz geändert werden muss, um die Salzkonzen-tration konstant zu halten, ist also falsch. Das sei nachstehend für einen Pickelansatz mit 100% Wasser und 5% Kochsalz (Säuremenge ist hier uninteressant), auf Blößengewicht berechnet demonstriert, wobei die in den Blößen vorhandene Wassermenge mit rund 65% angenommen wird.
Pickel 1: 100% Wasser + 5% NaCI = 5%ige Lösung
tatsächlich 165% Wasser +5% NaCI = 3,03%ige Lösung
Die Kochsalzkonzentration beträgt also tatsächlich rund 3%.
Pickel 2: 200% Wasser + 10% NaCI = 5%ige Lösung
tatsächlich 265% Wasser + 10% NaCI = 3,77%ige Lösung
Die Kochsalzkonzentration beträgt hier also rund 3,8%, also ist eine höhere
Pickelwirkung = geringere Quellung als beim Pickel 1 zu erwarten.
Pickel 3: 50% Wasser + 2,5% NaCI = 5%ige Lösung
tatsächlich 5% Wasser + 2,5% NaCI = 2,1 7%ige Lösung
Die Kochsalzkonzentration beträgt hier also rund 2,2%, also ist eine geringere Pickelwirkung = höhere Quellung als beim Pickel 1 zu erwarten.
Diese einfachen Überlegungen machen den Verlauf der Kurven in Bild 3 und Bild 4 unten verständlich. Um bei unterschiedlicher Flottenmenge die gleiche Quellung zu erhalten, muss man für die Berechnung der Kochsalzmenge auch den Wassergehalt der Blöße mit berücksichtigen. Nun ist es für den Praktiker zweckmäßiger, Säure-und Salzmenge stets auf Blößengewicht zu beziehen, da das seine allgemeine Bezugsgröße ist und er ungern in den Rezepturen noch mit einer zweiten Bezugsgröße arbeitet. Daher galt es, eine Formel zu entwickeln, die ihn die benötigte Salzmenge rasch errechnen läßt, wenn er das Pickelvolumen ändert. Ist AV = % bisheriges Pickelvolumen, NV = % neues Pickelvolumen auf Blößengewicht.
Bild 4
Für Pickel 3: 5 x 115/165 =3,485% Kochsalz (bei 115% Wasser = 3,03%ige Lösung)
In der Praxis wird man die Werte abrunden, man muss also bei Pickel 2 nicht 10%, sondern 8% Kochsalz verwenden und bei Pickel 3 statt 2,5% 3,5% Kochsalz einsetzen. Dann ist in allen Fällen die Kochsalzkonzentration konstant, und in der Tat wurden dann in den verschiedenen Pickeln auch gleiche Werte für Quellung und Prallheit erhalten, und dieser gleiche Quellungszustand ist im Interesse gleicher Lederqualität erforderlich.
IV. Zusammenfassung
Bei systematischen Untersuchungen über die Verminderung der Quellung und Prallheit tierischer Haut in Pickelsystemen, die durch direkte Messung der Dickenzunahme und Kompressibilität ermittelt wurden, wurden die folgenden Feststellungen getroffen.
1.Die entquellende Wirkung aller Salze wirkt sich mit steigender Salzkonzentration auf die Prallheit wesentIich stärker als auf die Quellung aus.
2.Die Salzmengen im Pickel vor der Chromgerbung müssen so eingestellt sein, dass die Quellung weitgehend unterdrückt wird (um so mehr, je weicher und geschmeidiger das herzustellende Leder sein soll), nicht aber negative Werte (Entquellung durch Wasserentzug unter die Wasserquellung) auftreten, da bei Festgerbung dieses Zustandes flache und leere Leder erhalten werden.
3.Die die Quellung unterdrückende Salzwirkung nimmt bei gleicher Normalität in der Reihenfolge Kochsalz, Natriumsulfat, Natriumformiat, Natriumacetat zu.
Zur völligen Vermeidung einer Säurequellung ohne Auftreten negativer Quellwerte genügen bei 1% Schwefelsäure 4% Kochsalz, 5% Natriumsulfat, 2,9% Natriumformiat bzw. 3,5% Natriumacetat. Im Ameisensäurepickel mit 1% Ameisensäure betragen die entsprechenden Werte 2,5%, 3,0%, 2,9% und 3,5%. Bei höheren Säuremengen liegen auch die benötigten Salzmengen höher, bei 2% Schwefelsäure 7,5% Kochsalz bzw. 5% Natriumformiat, bei 2% Ameisensäure 4,5% Kochsalz bzw. 5% Natriumformiat. Die in der Praxis verwendeten Salzmengen liegen meist höher und beeinflussen damit die Fülle des Leders ungünstig.
4.Der Temperatureinfluss auf Quellung und Prallheit ist bei Pickelsystemen relativ gering, für die völlige Unterdrückung der Säurequellung gelten für die verschiedenen Salze bei 35°C die gleichen Grenzwerte wie bei 25°C. Mit Kochsalz als Pickelsalz liegen die Quell- und Prallheitswerte bei 35°C etwas niedriger als bei 25°C, bei Natriumformiat als Pickelsalz umgekehrt bei 35°C etwas höher als bei 25°C, was wieder für eine gewisse hydrotrope Wirkung des Formiats bei höherer Temperatur spricht.
5.Die Gegenionenwirkung der Pickelsalze ist entsprechend dem Massenwirkungsgesetz eine Funktion der Salzkonzentration. Die in der Praxis übliche Regel, dass bei Änderung des Pickelvolumens auch die Salzmenge im gleichen Prozentsatz geändert werden muss, ist aber falsch, da die in der Blöße befindliche Wassermenge mitberücksichtigt werden muss. Es wird eine Formel mitgeteilt, die gestattet, bei Änderung des Pickelvolumens die zur Erreichung des gleichen Quellungszustandes benötigte Salzmenge zu berechnen.
Wir danken dem Bundeswirtschaftsministerium für die uns über die Arbeitsgemeinschaft Industrieller Forschungsvereinigungen gewährte wertvolle finanzielle Unterstützung dieser Arbeit. Ferner danken wir Frau A. Krämer für ihre verständnisvolle Mitarbeit bei der Durchführung der Untersuchungen.
Literaturverzeichnis
- H. Herfeld und B. Schubert, Das Leder 1975, 117
- W. Grassmann, Handbuch der Gerbereichemie und Lederfabrikation, 1. Bd., 1. Teii (Wien 1944) und 1. Bd., 2. Teil (Wien 1938); H. Herfeld, Grundlagen der Lederherstellung, Dresden und Leipzig 1950; F. Stather, Gerbereichemie und Gerbereitechnologie, Berlin 1967
- H. Herfeld und B. Schubert. Das Leder 1963, 77, 11 7; 1965, 25; 1966, 105
- A. Küntzel, Coli. 1930, 218
- B. Schubert und H. Herfeld, Das Leder 1975, 21
- Vgl. z. B. H. Herfeld, E. Häussermann und St. Moll, Gerbereiwissenschaft und Praxis, April 1967; H. Herfeld, St. Moll und W. Harr, Gerbereiwissenschaft und Praxis, Januar und Februar 1969
- F. Stather, H. Herfeld und S. Beyer, Ges. Abhandl. d. Deutschen Lederinstituts Heft 10 (1954), S. 52; Heft 1 1 (1955), S. 60; H. Herfeld und S. Beyer ebenda Heft 13 (1965),
- S. 69; H. Herfeld, S. Beyer und R. Andree, ebenda Heft 14 (1959), S. 131.
Kategorien:
Quellenangabe:
Zitierpflicht und Verwendung / kommerzielle Nutzung
Bei der Verwendung von Inhalten aus Lederpedia.de besteht eine Zitierpflicht gemäß Lizenz CC Attribution-Share Alike 4.0 International. Informationen dazu finden Sie hier Zitierpflicht bei Verwendung von Inhalten aus Lederpedia.de. Für die kommerzielle Nutzung von Inhalten aus Lederpedia.de muss zuvor eine schriftliche Zustimmung (Anfrage via Kontaktformular) zwingend erfolgen.
www.Lederpedia.de - Lederpedia - Lederwiki - Lederlexikon
Eine freie Enzyklopädie und Informationsseite über Leder, Ledertechnik, Lederbegriffe, Lederpflege, Lederreinigung, Lederverarbeitung, Lederherstellung und Ledertechnologie