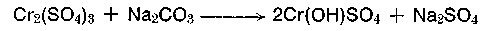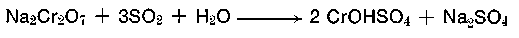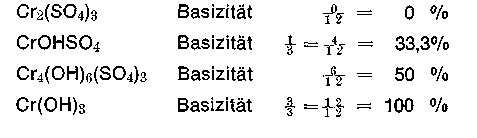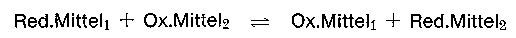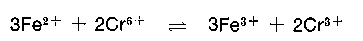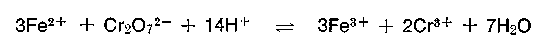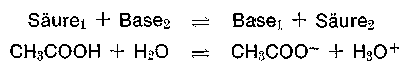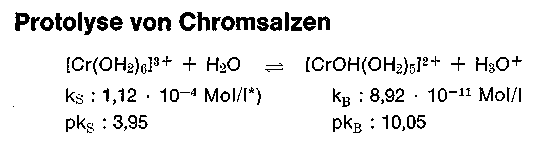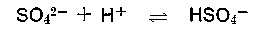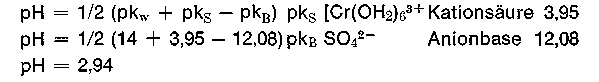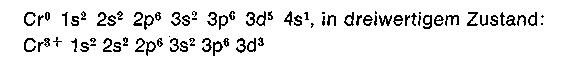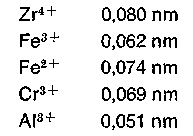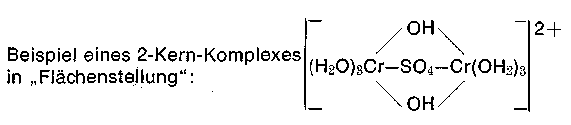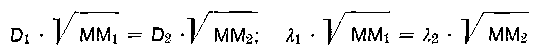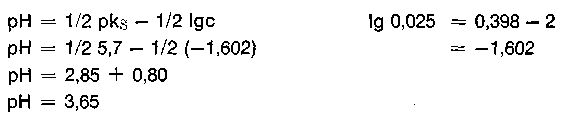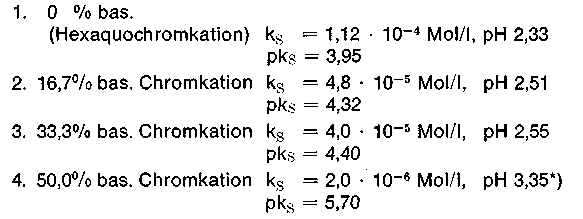Inhaltsverzeichnis
Chromgerbstoffe und Chromgerbung
Einführungsbetrachtung
1948 aus Stather Gerbereichemie und Gerbereitechnologie, Seiten 327,328
Nur selten hat die Einführung eines neuen Erzeugungsverfahrens auf irgendeinem Gebiete der angewandten Technik die gesamte wirtschaftliche Struktur des berührten Gebietes so grundsätzlich verändern können wie die Einführung des Chromgerbverfahrens in die Ledererzeugung, nur selten hat ein in seinen Grundprinzipien erkanntes Verfahren so lange Zeit bis zu seiner wirklichen technischen Ausnutzung benötigt wie die Chromgerbung. Die Chromgerbung war es, die die wirtschaftliche Umwandlung von der handwerklichen Gerberei zum industriellen Ledererzeugungsbetrieb und Großbetrieb mit seiner umfangreichen maschinellen Ausrüstung ermöglichte, die Chromgerbung war es, die die bis dahin neben etwas Alaungerbung und Fettgerbung dominierende Methode der pflanzlichen Gerbung in ihrer Bedeutung beträchtlich zurückdrängte. Dem deutschen Technologen F. Knapp gebührt die Ehre, die gerbende Wirkung der dreiwertigen Chromsalze entdeckt zu haben. Aus seiner 1858 veröffentlichten klassischen Arbeit „über die Natur und das Wesen der Gerberei und des Leders“ ist ersichtlich, daß er bereits wußte, daß die normalen Chromsalze als Gerbmittel wenig geeignet sind, daß er die wesentlichen Bedingungen und Eigenschaften einer brauchbaren Chromgerbbrühe, die Notwendigkeit der Anwesenheit des Chromgerbsalzes in basischer Form und auch die Bedeutung des Neutralsalzgehalts kannte. Daß seine Arbeit keinen praktischen Erfolg hatte, hat seinen Grund in der Tatsache, daß das Problem der Chromgerbung nicht nach rein wissenschaftlichen Gesichtspunkten gelöst werden konnte, vielmehr für diese dem vorherrschenden pflanzlichen Gerbverfahren ganz wesensfremde Gerbungsart erst neue Einzelprozesse der Fettung, der Zurichtung und. vor allem der maschinellen Ausrüstung geschaffen werden mußten. Die erste praktische Anwendung eines Chromgerbverfahrens in großwirtschaftlichem Maßstab ermöglichte das 1884 dem Amerikaner A. Schultz 1) patentierte Verfahren der sogenannten Zweibadchromgerbung, d. h. der Behandlung der Blöße mit Chromsäurelösung und nachfolgender Reduktion der aufgenommenen Chromsäure zu gerbendem basischem Chromsalz. Die Einführung der Einbadchromgerbung mit dreiwertigen Chromsalzen in die Praxis in Anlehnung an die grundsätzlichen Erkenntnisse Knapps gelang nach langjährigen, wenig erfolgreichen Versuchen 1893 M. Dennis 2). Auf den inzwischen gesammelten praktischen Erfahrungen mit der Zweibadgerbung aufbauend, könnte das Einbadchromgerbverfahren bald das Zweibadverfahren fast völlig verdrängen. Die Entwicklung und Verbreitung der Chromgerbung in Europa fand in H. R., Procter einen eifrigen Förderer, auf dem auch die Einführung des als Nebenprodukt der Alizarinfabrikation billig zur Verfügung stehenden Chromalauns als Chromgerbmittel zurückzuführen ist.
(geschichtlicher Überblick 1948) 1) Amerikanisches Patent 291784 2)Amerikanisches Patent 495028
Chemische und komplexchemische Grundlagen der Chromgerbung
Quelle: SONDERDRUCK 143 aus LEDER- UND HÄUTEMARKT „Gerbereiwissenschaft und Praxis„ Oktober und November 1978 von Dr. Johannes Otto aus der Arbeit der Westdeutschen Gerberschule, Reutlingen
Quelle aus: Sonderdruck 143
Chemische und komplexchemische Grundlagen der Chromgerbung
Diese Ausarbeitung hier befaßt sich mit den chemischen und komplexchemischen Vorgängen der klassischen Chromgerbung; dabei werden die Hydrolyseerscheinungen der Chromsalze in Brühen durch die Brönsted - Lowry -Theorie der Protolyte ersetzt. Mit den daraus resultierenden Säurekonstanten werden kleinere Berechnungen angestellt. Ein kleiner Teil der Abhandlung beschäftigt sich mit dem chemischen Aufbau von Chromkomplexen und beschreibt den räumlichen Bau von Mehrkernkomplexen. Des weiteren sind die wichtigsten Vorgänge wie Abstumpfen, Basizität, Verolung, Komplexaffinität, Maskierung und Entmaskierung mit für die Praxis wichtigen Beispielen erläutert. Am Ende werden die Vorgänge der Gerbung, der Entsäuerung und Trocknung vom komplexchemischen Standpunkt aus beleuchtet. Der letzte Abschnitt setzt sich mit der Teilchengröße der Gerbstoffe auseinander und behandelt zum Vergleich die Gerbintensität der mineralischen und vegetabilen Gerbung.
Das Metall Chrom und seine Verbindungen
Das Metall Chrom und seine Verbindungen sind nicht nur für den Gerber, sondern für die gesamte Wirtschaft von großer Bedeutung. Chrom kommt als Chromeisenstein Cr2O3 • 2FeO als graues Mineral in der Natur vor. Der größte Teil des gewonnenen Chroms wandert in die Stahlindustrie (Chromstähle), hier wird der Chromeisenstein mit Koks zum Ferrochrom reduziert. Zur Herstellung von löslichen Chromverbindungen muß das Chrom vom Eisen durch einen alkalischen oxydierend wirkenden Röstprozeß in Drehrohr- oder Ringherdöfen bei 1000° C getrennt werden. Nach Auflösen des Schmelzkuchens in Wasser und anschließender Filtration (Entfernung von Fe2O3) entsteht nach Absäuern Natriumdichromat (Na2Cr2O7). Dieses sechswertige Chrom hat ein hohes Oxidationspotential (E0 = 1,35 Volt) und dient unter anderem in der chemischen Industrie in schwefelsaurer Lösung seit langem als geschätztes Oxidationsmittel, um z. B. Farbstoffzwischenprodukte zu oxydieren. Das entstandene Chromsulfat kann zwar elektrochemisch wieder aufoxidiert werden, ein großer Teil dieses Salzes wird modifiziert und der Gerberei als Chromgerbmittel in gelöster oder fester Form angeboten. Durch Umsatz mit Soda entsteht ein 33,3% basisches Chromsulfat.
Auch bei der praktizierten Reduktion des Dichromates mit gasförmigem Schwefeldioxid gemäß nachstehend aufgeführter Formelgleichung
entstehen Neutralsalz und Chromoxid im äquimolekularen Verhältnis. Die Basizität des Gerbsalzes stellt sich automatisch auf 33,3% ein. Das B hinter den Firmennamen der Chromgerbextrakte deutet auf ein basisches Salz hin. Die Basizität beschreibt das Verhältnis der basischen Gruppen (Hydroxidgruppen) zu den Gesamtvalenzen des Chroms. Sie kann in Zwölftel-Angabe (Freiberger Basizität) oder nach Schorlemmer in Prozent-Dimension angegeben werden.
Bei der Umwandlung von 1 Mol Chromsulfat in 33,3% basisches Chromsulfat wird 1 Mol Soda benötigt. Da die Molekularmassen von Cr2O3 = 152, von Na2SO4 = 142 annähernd gleich sind, enthält ein handelsüblicher Chromextrakt (Chromosal B, Chromitan B) Cr2O3 und Na2SO4 (Neutralsalz) in annähernd gleichen prozentualen Verhältnissen.
Da der Rest zu 100% (ca. 40%) zum Chromgerbstoff gehört, ist das Verhältnis Cr2O3 zu Chromgerbmittel 26 : 66 wie 1 : 2,5. Alle Chromsalze — auch die 50% basischen Chromsalze — besitzen eine saure Reaktion. Zum besseren Verstehen dieser Reaktion ruft man sich die Brönsted'sche Theorie ins Gedächtnis. Die Säure - Base -Theorie der Stoffe hat die gleiche Wandlung erfahren wie die Theorie der Reduktions- und Oxidationsmittel.
Bei Elektronenabgabe wird dieses zum Oxidationsmittel. Beide zusammen bilden ein korrespondierendes Paar. Da freie Elektronen nicht existent sind, gehört zu jedem reagierenden Reduktionsmittel ein Partner (Oxydationsmittel), der diese Elektronen aufnimmt. Ein Oxydationsmittel ist demzufolge ein Elektronenfänger (Acceptor). 2 entsprechende korrespondierende Paare bilden ein Red-Ox-System.
Die beiden Partialvorgänge des Red-Ox-Systems heißen Oxydation und Reduktion.
Das sechswertige Chrom wird durch das zweiwertige Eisen zum dreiwertigen Chrom reduziert. Meist geht der pH-Wert in Red-Ox-Systeme ein, wodurch noch im stark sauren Gebiet das Oxydationspotential ansteigt.
Theorie nach Brönsted-Lowry
Nach Abgabe von H+ wird auch hier die Säure zur korrespondierenden Base. Eine Base ist somit ein H+ -Fänger (Acceptor). Da auch hier keine H+ (p) existent sind, gehört zur Säure- bzw. Basewirkung ein Partner, der H+ aufnimmt oder abgibt. In wäßrigen Systemen wirkt Wasser als p-Fänger. 2 entsprechende korrespondierende Paare ergeben ein Protolyse-System, in dem ein Protonenübergang stattfindet.
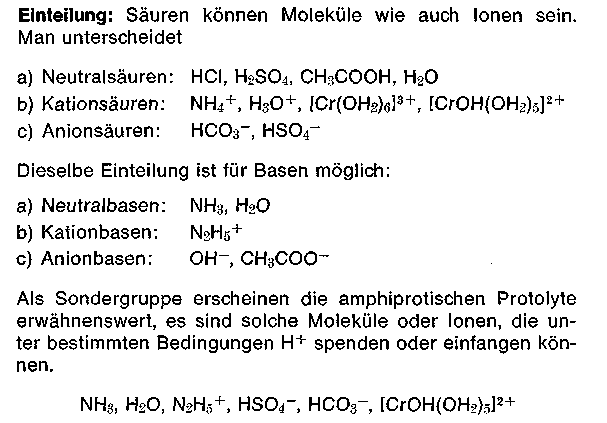
Die H3O+ (Oxoniumionen) oder die stärker hydratisierten H9O4 + (Hydroniumionen) sind die Träger der sauren Reaktion. Der negative dekadische Logarithmus der Oxoniumio-nenkonzentration cH3O+ ist der pH-Wert. Säuren und Basen haben zum Unterschied von Salzen keinen lonenaufbau (lonengitter) und werden als potentielle Elektrolyte, heute Protolyte bezeichnet. Die Bindung ist kovalent. Elektrolyte sind heute nur noch Stoffe, die im festen Zustand aus Ionen aufgebaut sind wie Salze, Oxide, Hydroxide. Die Bindung ist elektrovalent.
Alle Protolyte haben mehr oder weniger starke polarisierte Atombindungen, Bindung mit großen Elektronegativitätsdifferenzen zwischen den jeweiligen Atomen. Wendet man auf das Protolysegleichgewicht das Massenwirkungsgesetz an, so erhalten wir Gleichgewichtskonstanten, die als Säure- und Basekonstanten ks und kB bekannt sind. Mit Hilfe dieser Konstanten können alle Protolyte in schwache, mittelstarke und starke eingeteilt werden.
Gute Pufferwirkung besonders in äquimolekularen Mischungen; der pH-Wert dieser Lösung im Molverhältnis 1 entspricht dann dem pks-Wert der jeweiligen Puffersäure. In diesem pHBereich puffert das jeweilige Gemisch optimal.
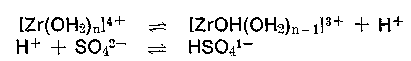
Eine 0,2 m Lösung einer 0% basischen Chrombrühe hat demzufolge einen pH-Wert von 1,98 + 0,35 = 2,33 (Sulfat als Base unberücksichtigt). Alle Chromsalze reagieren also mehr oder weniger stark sauer, wobei der kationische Teil (das hydratisierte Chromkation) der Protonenspender ist. Da auch das Anion vom Salz, das Sulfation, protonenwirksam ist,
kann der pH-Wert der Chromsalzlösung verschiedener Säuren mit der Formel
wirklich nur annäherungsweise berechnet werden, die Rechnung wird umso genauer, je schwächer die Anionbase vom Salz ist. Das SO4 2- : pkB 12,1 ist zwar schon eine ziemlich schwache Base, erhöht jedoch den aus der Formel berechneten pH-Wert etwas. Will man die „Sulfatbase“ mit berücksichtigen, dann bietet sich folgende Formel an, die zwar auch den pH-Wert nur annähernd wiedergibt. Die Konzentration bleibt hier unberücksichtigt.
Eine 0,2 m kalt bereitete Chromsulfatlösung hat einen sofort gemessenen pH-Wert von 2,68, dies entspricht einer cH+ = 2,1 • 10-3 Mol/l, eine entsprechende Chromchloridlösung hat einen *) In der Literatur findet man für die Hexaquochromkationsäure auch einen pks-Wert von 4,16. Der entsprechende pH-Wert in 0,2 m Konzentration beträgt dann 2,43. pH-Wert von 2,43 und eine Wasserstoffionenkonzentration von 3,7 • 10-3 Mol/l. In beiden Fällen haben wir es mit derselben Hexaquochromkationsäure zu tun. Im Gegensatz zum Sulfat ist das Chloridion eine derart schwache Anionbase, daß sie kaum protonenwirksam ist und somit den pH-Wert nicht beeinflußt.
Da aber bei Chromsulfaten schon nach einiger Zeit Ligandensubstitution durch Sulfationen (Sulfatokomplexbildung) und Verolung eintritt, ist der augenblickliche Zustand - die exakte Formel - des Chromsalzes kaum festzulegen. Die Sulfatokomplexbildung führt zur Verminderung, die Verolung zur Erhöhung der Wasserstoffionenkonzentration.
Kurze Komplexchemie
Um den nun folgenden Teil zu verstehen, sind einige Kenntnisse der Chromkomplexchemie wichtig. Chrom (Ordnungszahl 24) hat im Grundzustand die folgende Elektronenkonfiguration:
Chrom bildet im allgemeinen High-Spin-Komplexe mit einer d2 sp3 -Elektronenkonfiguration mit 3 ungepaarten Elektronen, die der Verbindung einen entsprechenden Paramagnetismus von ca. 3,88 BM (Bohr'sche Magnetone) erteilen. Die Anordnung der Liganden erfolgt oktaedrisch. Ob innere Orbitale (Low-Spin) oder äußere Orbitale (High-Spin) aufgebaut werden, hängt auch sehr von der Elektronegativität der Liganden ab. Liganden mit kleiner Elektronegativität wie z. B. das |C = N|- bevorzugt die Ausbildung innerer Orbitale, die Bindung ist stark kovalent. Diese Komplexe wurden früher als Durchdringungskomplexe bezeichnet. Liganden mit hoher Elektronegativität wie das F- bilden ionisch gebaute, früher Anlagerungskomplexe. Die Bindung ist sehr stark polarisiert. Einen Chromkomplex stellt man sich räumlich als einen Oktaeder (Achtflächner) vor, in dessen Mitte das Chromion liegt und in Richtung der Spitzen die Liganden in koordinativer (mehr oder weniger stark polarisierte Atombindung) Bindung sich befinden. Man spricht hier von einer Koordinationszahl 6.
Liganden können Moleküle H2O NH3 aber auch Ionen SO4 2-, HCOO-, OH- sein; meist stellt ein Ligand ein freies Elektronenpaar zur Bindung zur Verfügung (Donorbindung). Besetzen diese Liganden eine Stelle im Koordinationspolyeder, dann nennt man sie einzähnig, sie können auch zwei und mehr Stellen besetzen, dann heißen diese mehrzähnige Liganden. Mehrzähnige Liganden nennt man gelegentlich auch Chelatliganden, die Gebilde Chelatkomplexe. Die Zähnigkeit hängt nicht mit der Wertigkeit, sondern mit der Zahl der Elektronenpaare der Liganden zusammen, die mit den Orbitalen des Chroms Hybridorbitale bilden. Ein mehrzähniger Ligand kann auch als Brückenligand zwischen 2 Oktaedern fungieren, man nennt dann diese μLiganden, die Gebilde Mehrkernkomplexe. Ein Sulfation z. B. kann eine oder zwei Koordinationsstellen am gleichen Oktaeder oder je eine zweier Oktaeder besetzen. Auch das Hydroxidion, Formiation kann als Brückenligand wirken.
Verolung
Eine Aggregation von Hydroxokomplexen unter Wasseraustritt, die zur Molekülvergrößerung führt, wird als Verolung bezeichnet. Diese für den Gerber wichtige Reaktion wird später eingehend behandelt. Verolungsvorgänge spielen in der analytischen und Kolloidchemie (Veränderung von Niederschlägen beim Stehen, Gelbildung) eine Rolle und werden dort als Alterung bezeichnet. In der Mineralgerbung sind neben Chrom auch die Elemente Zirkonium, Eisen und Aluminium interessant. Zirkonium- und Eisensalze mit schwachen Anionbasen (Cl-, SO4 2-) reagieren im Gegensatz zu Aluminium- und Chromsalzen stark sauer, wie folgende Protolysekonstanten und pH-Werte zeigen.
Die Tatsache, daß besonders höherwertige hydratisierte Metallionen als Säuren wirken, hängt mit dem kleinen Atom- bzw, lonenradius der höherwertigen Metalle zusammen:
Bei Metallen sind im Gegensatz zu den Nichtmetallen die Atomradien größer als die lonenradien. Alle Übergangsmetalle haben im Gegensatz zu den Alkali- bzw. Erdalkalimetallen einen kleinen lonenradius und durch die hohe Kernladung eine hohe Ladungskonzentration. Diese Metalle sind daher zur Komplexbildung besonders ausgezeichnet.
Wir sehen daraus, daß die hydratisierten Zirkonium- und Eisenionen starke Brönsted'sche Kationsäuren sind. Gerbend wirken hier im Gegensatz zum Chrom und Aluminium mit großer Wahrscheinlichkeit Isopolyanionen, hier bilden wesentlich die basischen Gruppen der Haut die Koordinationsstellen für die Bindung dieser Gerbstoffe, obwohl auch andere unspezifische Bindungen mitbeteiligt sind. Der Bindungsmechanismus der Gerbung kann leicht erkannt werden, wenn man entweder die sauren Gruppen verestert oder die basischen Gruppen des Kollagens acetyliert, also blockiert und in Gerbversuchen die Abnahme oder Zunahme der Gerbstoffbindung des so veränderten Kollagens verfolgt. Auch die Erhöhung oder Senkung des isoelektrischen Punktes ergibt Anhaltspunkte über den Bindungsmechanismus der Gerbung. Ein weiterer Beweis der Bindung anionischer Eisenkomplexe ist auch der „vegetabile„ Griff dieser Eisenleder. Hydratisierte Zirkoniumionen protolysieren (deprotonieren) schon bei sehr tiefen pH-Werten im Gegensatz zum Chrom sehr stark. Als Protonenacceptor wirkt hier schon die schwache Anionbase S04 2- bei Sulfaten.
Beim Chrom wird dagegen zur weiteren Deprotonierung (Abstumpfen) die starke Anionbase CO3 2- benötigt. Beim Verdünnen und in der Wärme (Verstärkung der Protolyse) kann schon bei pH-Werten ab 1,5 (Der Grenz-pH-Bereich der optimalen Fällung von Zirkoniumsalzen liegt zwischen pH 2,8—4,5) wenn auch unvollständig, Trübungen bzw. Fällungen von ZrO2 • aq (Zirkoniumdioxidaquat) entstehen, die jedoch bei Anwesenheit von Schwefelsäure oder Sulfationen auf Grund hoher Komplexaffinität der Sulfationen zu anionischen Komplexen z. B. [ZrO(SO4)2] 2- gelöst werden können. In Anfangsgerbbrühen liegen wahrscheinlich durch Aggregierung, die hier schnell verläuft, Isopolysäuren ähnlich denen des Eisens vor, was wohl nicht mit dem Verhalten der mit Zirkoniumsalzen gegerbten Ledern gegenüber anionischen Stoffen wie vegetabilen Gerbstoffen und Farbstoffen befriedigend erklärt werden kann. Auch das allein mit Zirkoniumsalzen gegerbte harte, feste Leder nimmt wie das „Eisenleder“ im Charakter eine Mittelstellung zwischen pflanzlich gegerbtem und chromgaren Leder ein. Daß es auch definierte aggregierte kationische Deprotonierungsprodukte z. B. [Zr4(OH)8(OH2)16] 8+ gibt, soll nicht verschwiegen werden. Dem Analytiker ist bekannt, dass manche Reaktionen auf Zirkonium durch Schwefelsäure oder Sulfationen gestört werden.
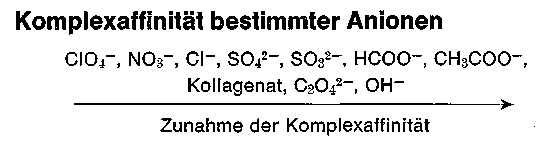
Zum besseren Verständnis der komplexchemischen Vorgänge bei der Chromgerbung ist das unterschiedliche Verhalten der Gegenionen des Komplexes und der Fremdionen gegenüber den bereits vorhandenen Liganden interessant. Das unterschiedliche Bestreben gewisser Moleküle wie H20 NH3 und Anionen verschiedener Säuren oder deren Salze als Liganden in den Komplex einzutreten, faßt man unter dem Begriff Komplexaffinität oder Ligandensubstitution zusammen. Komplexaffine Anionen haben ein großes Bestreben, aus der äußeren in die innere Sphäre unter gleichzeitiger Verdrängung weniger komplexaffiner Liganden zu gehen. Ein Vergleich dieser Tendenz ist nur in äquimolekularen Verhältnissen der Anionen möglich. Nachstehend ist eine Reihe von Ionen aufgezeichnet, wobei jeweils das rechtsstehende Anion das linksstehende aus komplexer Bindung verdrängt. Dieser sogenannte „Maskierungsvorgang„ vollzieht sich langsam, er ist umso vollständiger, je schwächer die zum Anion korrespondierende Säure ist.
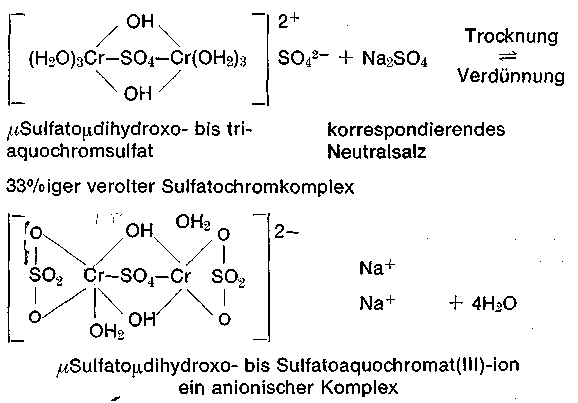
Auch das Sulfonation -SO3- bestimmter Farbstoffe, Hilfsmittel, Fettstoffe und gewisser Syntane hat eine hohe Komplexaffinität. NH3 - Moleküle zeigen fast immer eine größere Ligandensubstitution als H2O Moleküle. Man sieht daraus, dass besonders in hohen Konzentrationen mit komplexaffinen Anionen wie Oxalat-, Hyroxid- und sogar mit bestimmten Anionen von Farbstoffen das Kollagenation aus dem Komplex verdrängt werden kann (entgerbende Wirkung). Da sich stets ein Gleichgewicht zwischen Anionen bzw. Sulfationen der Lösungen und Acidoliganden (Sulfatoliganden) einstellt, so kann dieses durch Konzentrationsänderung (Trocknung, Verdünnung) nach der einen oder anderen Seite verschoben werden. Ein praktisches Beispiel ist die Umladung bei Sulfatokomplexen im „Ungelöst-Verfahren“.
Bei der Trocknung zur Herstellung von Extrakten wird Wasser auf der rechten Seite des Gleichgewichtes entfernt, die Sulfationenkonzentration vom Komplex- und Neutralsalz in der Lösung wird größer und somit steigt die Komplexaffinität an, wobei sich bis zu einer neuen Gleichgewichtseinstellung überwiegend anionische Komplexe bilden (Sulfatmaskierung). Beim Verdünnen vollzieht sich der umgekehrte Fall, gleichzeitig werden die gerbaktiven kationischen Teilchen von der Haut bevorzugt gebunden und somit dem Gleichgewicht entzogen; es hat eine Entmaskierung stattgefunden, dies zeigt deutlich, daß die Komplexaffinität der Anionen von der Konzentration abhängig ist. Dieses Verfahren war erst möglich durch die Einführung der mildwirkenden Sprühtrocknung. Eine Umladung findet auch bei bestimmten selbstabstumpfenden Chromextrakten (Chromitan MS) statt. Da die Basizität bereits ca. 50% hier beträgt, hat das Chromteilchen nach Umwandlung sofort die optimale Gerbwirkung.
Entolung
Die Umkehrung der Verolung ist die Entolung. Verolte Chromkomplexe sind gegenüber Säuren verhältnismäßig stabil. Die Ol-Bindungsliganden sind jedoch nicht gleich widerstandsfähig. Die Anwesenheit bereits vorhandener Liganden beeinflußt die Aufspaltung der Ol-Liganden mit Säure, wobei ein Teil der Säure verbraucht wird. Wenn auch Entolungsreaktionen nicht direkt für den Gerber interessant sind, so spielten früher partielle Entolungsreaktionen durch Hitze bei auf Walzen getrockneten Extrakten eine Rolle. Werden Chromlösungen beim Trocknen nämlich über längere Zeit auf höhere Temperaturen (Walzentrocknung) gehalten, so schreitet die Verolung und Sulfatmaskierung weiter fort. Gleichzeitig gehen ein Teil der Ol-Liganden durch Wasserentzug in Oxoliganden über, wodurch die Wasserlöslichkeit stark abnimmt. Erst durch ein Aufkochen dieser heute nicht mehr hergestellten Extrakte fand ein reversibler Zerfall (Entmaskierung und Entolung) in 1—2 Tagen statt, der zur vollständigen Wasserlöslichkeit und damit erst zum Einsatz dieser Gerbstoffe führte.
Räumlicher Bau von Ein- und Mehrkernkomplexen
Soeben begegneten uns Chromkomplexteilchen mit 2 Chromatomen, diese nennt man Zweikernkomplexe. Nach der Zahl der Zentralatome unterscheiden wir ein Ein- und Mehrkernkomplexe; es handelt sich um Ketten oder vernetzte Gebilde. Die Bindung zweier Oktaeder findet über µLiganden (Brückenliganden) statt. Übernimmt ein Brückenligand die Bindungsfunktion, so sprechen wir von Spitzenstellung, bei zwei von Kantenstellung und bei drei von Flächenstellung der Oktaeder, bei letzterem wird unter Energieabgabe die Stabilität der Komplexteilchen gesteigert. In der Praxis haben wir es vornehmlich mit der Kanten- und Flächenstellung zweier Oktaeder zu tun. Handelt es sich um μHydroxoliganden (Ol-Liganden), dann spricht man auch von einer Diol- bzw. Triol Struktur dieser Komplexteilchen.
Abstumpfen und Verolung von Chromkomplexsalzen
Wie bekannt, wird die saure Reaktion der Chromsalze in Brühen durch Protolyse hervorgerufen. Der noch geläufige Begriff Hydrolyse sollte für diese Art von Reaktion verschwinden und nur noch für solche Reaktionen vorbehalten bleiben, bei denen kovalente Bindungen durch Wasser aufgespalten werden (Verseifung von Fetten, Kohlehydraten, Polypeptiden etc.).
[Cr(OH2)6] 3+ + H2O Protolyse [CrOH(OH2)5] 2+</chem> +H3O+ Hexaquochromkation Hydroxopentaquochromkation
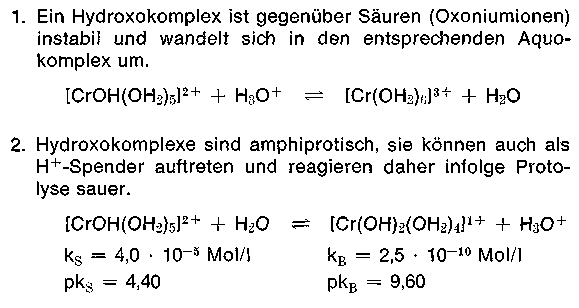
Aus den bereits bekannten Konstanten ersehen wir, daß das Gleichgewicht weitgehend auf der linken Seite liegt. Das rechtsstehende Protolyseprodukt ist die korrespondierende Base mit Gegenion (z. B. SO4 2-), das „basische Salz„. Bei jeder Säure, so auch bei [Cr(OH2)6] 3+ stellt sich sofort ein bestimmter konstanter pH-Wert ein, der die Gleichgewichtslage bestimmt, in unserem Fall in 0,2 m Lösung ca. 2,33 pH. Bei vielen Aquokomplexen, so auch beim Chrom, bleibt dieser Wert jedoch nicht konstant, sondern er sinkt nach Tagen, Wochen und Monaten immer mehr ab, diese Erscheinung kann nur mit einer Störung des Protolysegleichgewichts erklärt werden, eine Erscheinung, die der Gerber bewußt durch Abstumpfen herbeiruft. Um dieses Phänomen zu verstehen, müssen wir die Eigenschaften von Hydroxokomplexen genauer studieren.
Das Protolysegleichgewicht liegt gemäß dieser Konstanten noch weiter auf der linken Seite, als das entsprechende Hexaquokation. Ein 33,3% basisches Chromsalz z. B. Chromosal B, Chromitan B reagiert bei pH 2,5-2,6 in 0,2 molarer Lösung.
3. Hydroxokomplexe aggregieren, sie lagern sich unter Wasserabspaltung zusammen. Aus Einkernkomplexen entstehen Mehrkemkomplexe. Die Reaktion, die zur Molekülvergrößerung führt, nennt der Gerber Verolung (Alterung). Verantwortlich für die Verolung sind Hydroxoliganden. Hydroxokomplexe entstehen bei Basizitätsanhebung, also beim Abstumpfen.
Die freiwillige in einer Zeitreaktion verlaufende Verolung ist ein Grund für die Störung des Protolysegleichgewichtes und damit für das Absinken des pH-Wertes. Chrombrühen werden beim Stehen, Leder beim Lagern auf dem Bock, sauer.
Die früher gepunkteten (Nebenvalenz) oder gestrichenen (Hauptvalenz) Valenzen /0H\ schreibt man zweckmäßig nur noch als Striche, da die Bindungen gleichwertig sind. Der verolte Komplex auf der rechten Seite kann nicht weiter verolen, da er keine Hydroxo- (unverolte) Gruppen mehr enthält. Um weitere Verolung und damit größere, gerbaktive, adstringente Teilchen zu erhalten, müssen mehr Hydroxogruppen in den Komplex eingeführt werden.
Das Protolysegleichgewicht muß also stärker durch Entnahme der Oxoniumionen aus dem Gleichgewicht gestört werden. Diese chemische Reaktion ist eine partielle Neutralisation, der Chemiker nennt sie Abstumpfen.
Das Abstumpfen
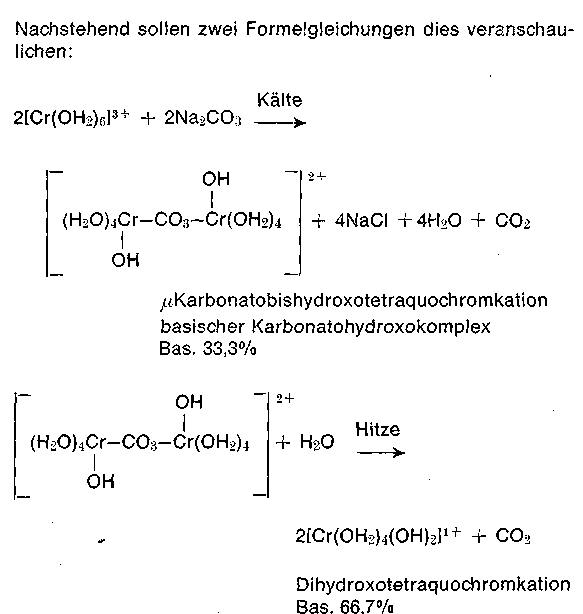
(Basifizierung) geschieht mit Anionbasen wie CO3 2-, HCO 3-, O2-, also Soda, Natriumhydrogencarbonat (Natron) oder MgO. Auch schwer lösliche Stoffe wie Kreide (CaCO3), Magnesit (MgCO3) oder Dolomit (CaCO3 • MgCO3) können zur Basifizierung eingesetzt werden (Selbstabstumpfende Chromextrakte, Baychrom-Marken).
Der Abstumpfvorgang - wie jede partielle Neutralisation - muß gesteuert werden, da im Äquivalenzpunkt ein Potentialsprung, beim Abstumpfen ein Ausfallen der Chromteilchen resultiert. Um die Vorgänge Diffusion der Chromteilchen in die Haut und die Bindung derselben an das Kollagen zu trennen, wird das Abstumpfen noch oft zeitlich verlagert. Bei der Verwendung von Soda und Natron können sich in der Kälte und am Anfang wenig beständige Karbonatokomplexe bilden, die während der Gerbung im Faß sich in Hydroxokomplexe höherer Basizität umwandeln. Hieraus folgt auch die Tatsache, daß in der Kälte mit Karbonaten basisch gestellte Brühen durch schwache instabile Maskierung eine mildere Gerbwirkung zeigen, dessen Effekt jedoch mit der Zeit verschwindet. Da die maßanalytisch ermittelte Basizität in der Siedehitze durchgeführt wird, entstehen Unterschiede, wobei die Basizität im Gerbfaß meist geringer ist.
Die über 40° C gesteigerte Temperatur am Ende der Gerbung begünstigt eine Verschiebung des Protolysegleichgewichtes zu Gunsten höherer Basizitäten und zur Steigerung der Verolung; dies führt, wie evtl. auch eine Verdünnung der Brühe am Ende der Gerbung, zur besseren Auszehrung und Bindung. Zweckmäßig dosiert man die Abstumpfchemikalien bis zu einem für jede Lederart typischen pH-Wert z. B. 3,7 ± 0,1 pH. Höhere pH-Werte bringen bessere Auszehrung mit Nachteilen für das Leder. Brühen für Leder mit feinerem Narben z. B. Kalbleder (Box) stumpft man daher lieber etwas niedriger ab. Der Chromoxidgehalt in Restbrühen ist zwar größer, eine Rückgewinnung des Chroms oder ein Recycling ist meist wegen Abwassergesetzen erforderlich. Ein anderer Weg ist die Berechnung der Abstumpfchemikalien, die man nach einiger Zeit erst zugibt, um Diffusion und Bindung zu trennen. Auch in der Mineralgerbung gilt die „Goldene Gerberregel“. Nur liegen hier die Konzentrations- und pH-Verhältnisse zur vegetabilen Gerbung umgekehrt. Eine saure Chrombrühe in hoher Konzentration (Chromtrockengerbung) ist weniger adstringent, als die vegetabile.
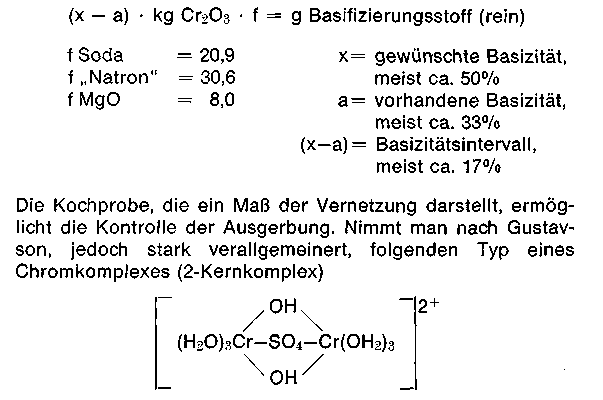
Ein Maß für die Adstringenz, wenn auch nicht exaktes, bildet die Ausflockungszahl (ml n/10 NaOH/50 mg Cr), die angibt, wie weit sich der Gerber mit seiner Brühe vom Flockungspunkt befindet. Der Alkaliverbrauch bis zur ersten Trübung verhält sich demnach umgekehrt proportional zur technisch erreichbaren Basizität; diese Kennzahl ist ein zwar ungenaues Maß für die Adstringenz. Die Ausflockungsbasizität handelsüblicher Chromsulfatbrühen liegt zwischen 55—60%. Werden alle Basizifierungsstoffe bei selbstabstumpfenden Chromextrakten, ohne daß die basisch gestellten Gerbstoffe mit der Haut reagieren können, umgesetzt, dann ergibt sich eine Endbasizität, die als „theoretische Basizität„ bezeichnet wird. Sie beträgt It. Prospekten ca. 65%. Die Berechnung der Abstumpfmittel erfolgt leicht nach folgender Gleichung:
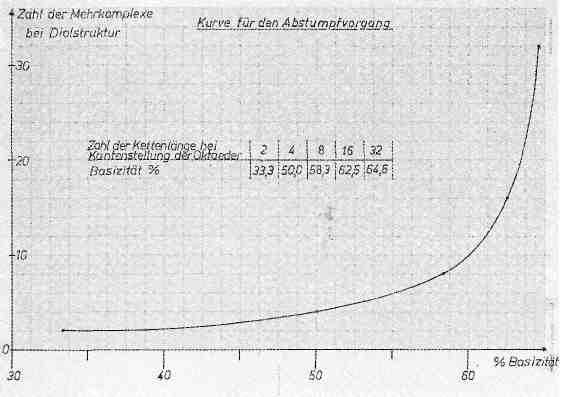
in einer Anfangschrombrühe von 33,3% Basizität an, dann liegen bei einer Basizität von ca. 50% 4—6 Kernkomplexe vor. Jede Chrombrühe stellt jedoch ein polydisperses System mit ständig sich durch Verolung verändernden Teilchen dar. Nimmt man eine „Diolstruktur“ an, dann errechnen sich statistisch folgende Teilchengrößen:
Basizität & Teilchengröße
| Basizität | Teilchengröße |
|---|---|
| 33,3% | 2 Kernkomplexe |
| 50,0% | 4 Kernkomplexe |
| 58,3% | 8 Kernkomplexe |
| 62,5% | 16 Kernkomplexe |
| 64,6% | 32 Kernkomplexe |
Über 55% beginnt eine kritische Grenze der Basizität, die Teilchen werden immer schwerlöslicher und flocken schließlich aus und gehen somit dem Gerbvorgang verloren. Mit Hilfe von Diffusions- bzw. Dialysemethoden nimmt man an, daß 4—6 Mehrkernkomplexe die Hauptvertreter der polydispersen Chrombrühe im optimalen Gerbzustand sind. Das hochaggregierte Chromkomplexteilchen nähert sich in seiner Zusammensetzung einem „gealterten Chromhydroxid„, das eine Abnahme der Reaktionsfähigkeit zu anionischen Stoffen zeigt. Die Diffusionskoeffizienten D und die Dialysekoeffizienten λ sind leicht bestimmbar. Zwischen beiden Koeffizienten und der Molekularmasse MM besteht folgende Beziehung:
Es ist einleuchtend, daß ein Stoff umso langsamer diffundieren oder dialysieren wird, je schwerer er ist. Trägt man die gemessenen Diffusionskoeffizienten (sie stellen ein Maß für die Diffusionsgeschwindigkeit dar) auf der Ordinate in Abhängigkeit vom pH-Wert auf der Abzisse graphisch dar, so erhält man im Gegensatz zu vielen Isopolysäuren eine stetig abfallende Kurve. Es lassen sich demnach keine bestimmten pH-Bereiche feststellen, in denen die Molekularmasse (Teilchengröße) konstant bleibt. Wir finden stufenlose Übergänge vom einfach molekularen Komplexkation im stärker sauren Bereich bis zum höchstbasischen und damit höchstmolekularen Protolyseprodukt, das überhaupt noch in wäßriger Lösung beständig ist. Dabei stehen all diese Mehrkernkationen in Abhängigkeit vom pH-Wert miteinander im Gleichgewicht. Es ist daher praktisch nicht möglich, reine Isopolybasen bestimmter Molekularmasse bei einem bestimmten Protolysegleichgewicht (früher Hydrolysegleichgewicht) mit einer bestimmten Teilchengröße zu isolieren. Wie die Basizität, so stellt auch die Teilchengröße ein Mittel aller Basizitäten bzw. Teilchengrößen dar. Die nachstehend aufgezeichnete Graphik zeigt die Veränderung der Teilchengröße zur Basizität an, obwohl die Basizität nicht unbedingt im direkten Verhältnis zur Teilchengröße steht.
Im Endstadium der Gerbung, beim Lagern der Leder auf dem Bock und weiteren anschließenden Prozessen sowie Trocknung erfahren die im Leder eingebrachten Chromsalze eine weitere komplexchemische Veränderung durch Alterung. Mit steigender Zunahme der Verschiebung des Protolysegleichgewichtes zu den Protolyseprodukten (Verolung) nimmt die mittlere Kettenlänge der isopolybasischen Chromverbindungen und damit die durchschnittliche Molekularmasse mehr und mehr zu, wobei auch die Zahl der Aquoliganden abnimmt. Die Teilchen nähern sich in ihrer chemischen Zusammensetzung weitgehend dem aggregierten Chromhydroxid. Chromhydroxidaggregate zwischen 80-200 Chromatome sind bekannt.
Wie beim Eisen können auch mit Wahrscheinlichkeit Parallelketten entstehen, die untereinander verbunden sind. Es werden beim eingelagerten Chromsalz im Leder Kettenlängen mit großer Wahrscheinlichkeit bis zu 40 Chromatomen angenommen, wobei die Molekularmassen oder Teilchenmassen dann bis zu 6000 ansteigen können. Die Bindung wird dadurch weiter verstärkt, wobei die Auswaschbarkeit der Gerbstoffe abnimmt.
Basizität in Restbrühen
Da aus der polydispersen Chrombrühe Chromteilchen höherer Kettenlänge durch ihre erhöhte Adstringenz bevorzugt von der Haut gebunden werden, ist die analytisch ermittelte Basizität einer Restchrombrühe verständlicherweise stets niedriger als die durch Abstumpfen berechnete und erzielte Basizität, wobei auch ein Teil von Säure, der bei Verolungsvorgängen und bei der Bindung an die Haut frei und nicht von den Aminogruppen des Kollagens gebunden wird, mit im Rahmen der Basizitätsbestimmung neutralisiert werden muß. Dabei entsteht ein höherer Alkaliverbrauch, der eine niedere Basizität vortäuscht. Der Chromoxidgehalt einer klassisch geführten Chromgerbung beträgt ca. 7,5 ± 2,5 g/l Restbrühe, ihre analytisch ermittelte Basizität nur ca. 30%. Dieser hohe Cr2O3 - Gehalt, ob in Kurz- oder Langflotten, bringt wirtschaftliche Nachteile (65% Ausbeute des Chromangebotes) und große Schwierigkeiten mit den Abwasserbehörden.
Auf Grund des gemessenen pH-Wertes einer 50% basischen Chromsulfatbrühe durch Protolyse läßt sich, wenn man mit Annäherung Chrom-4-Kernkomplexe der allgemeinen Formel Cr4(OH)6(SO4)3 annimmt, eine Säurekonstante ks von 2 • 10 -6 Mol/l und die korrespondierende Basekonstante kB von 5 • 10 -9 Mol/l berechnen. Der pks-Wert beträgt dann 5,7, der pkB - Wert 8,3. Mit diesen Konstanten, wie auch mit den in nachstehender Tabelle aufgeführten Werten, auch wenn diese mehr wissenschaftlichen Charakter haben, lassen sich einige praktische Berechnungen anstellen. Nimmt man z. B. eine Cr2O3 -Konzentration von 7,6 g/l (klassische mittlere Restbrühenkonzentration) an, dann entspricht dies einer Cr2O3 -Konzentration von 0,05 m (Molekularmasse Cr2O3 = 152) und einer Konzentration an 4-Kern-Chromkomplexen von 0,025 m.
Unter der jedoch rein theoretischen Annahme einer monodispersen Chrombrühe nur der einen Teilchengröße berechnet sich der pH-Wert von:
Danach scheint es gerechtfertigt zu sein, eine Chrombrühe bis ca. pH 3,7 abzustumpfen, was dem früheren Hydrolysen-pH-Wert diesem 50% basischen 4-Kern-Komplex numerisch entsprach.
Nachstehende Tabelle gibt die Konstanten und die pH-Werte in 0,2 m Konzentration an Cr2O3 wieder.
*) pH-Wert unter der Annahme eines 4-Kern-Komplexes (statt 0,2 m: 0,1 m)
Maskierung
Um eine milde Angerbung und eine Trennung der Vorgänge von Diffusion und Bindung herbeizuführen, empfiehlt es sich, die Chromgerbstoffteilchen bei einer klassischen Gerbung in ihrer Affinität zur Haut zu verändern. Der Chromkomplex sollte am Beginn der Gerbung gegenüber den komplexaffinen Gruppen des Kollagens abgeschirmt werden. Durch den Einbau von komplexaffinen Liganden wie z. B. Formiationen werden Aquoliganden aus dem Komplex entfernt, so daß die Protolysierfähigkeit und damit die Bildung von Hydroxokomplexen, die zur Verolung führen, herabgesetzt wird. Die Maskierung muß jedoch gesteuert werden, um für die Vorgänge der anschließenden Bindung und Reaktion mit anionischen Körpern noch genügend austauschfähige Liganden (Aquoliganden) zur Verfügung zu haben. Da die Sulfationen bereits eine merkliche Komplexaffinität besitzen, zeigen Sulfatbrühen schon die Merkmale einer partiellen Maskierung (Anmaskierung), so daß besonders konzentriertere Sulfatbrühen zur Angerbung geeignet sind. Auch die in der Kälte mit Soda abgestumpften Brühen sind anmaskiert und daher für eine milde Angerbung vorteilhaft.
Daß durch den Einbau von Anionen der kationische Charakter der Chromkomplexe gedämpft wird, versteht sich von selbst. Im „Ungelöst-Verfahren“ hat der Chromkomplex beim Trocknen sogar eine Umladung erfahren, die zu einer Gerbinaktivität durch zu starke temporäre, jedoch reversible Maskierung führen kann. Auch bei der Selbstreduktion von Dichromaten in schwefelsaurer Lösung mit Zuckerstoffen unter bestimmten sogenannten „milden Bedingungen„ entstehen maskierte Brühen, weil durch den partiell oxidativ geführten Abbau der Zuckerstoffe organische Säuren mit hoher Komplexaffinität entstehen. Die Maskierung kann in vielen Stadien der Gerbung durchgeführt werden. Die Zugabe von Maskierungssalzen im Pickel bietet den Vorteil, daß die Chrombrühe bereits zu Beginn der Gerbung infolge der Zeitreaktion maskiert ist.
Aromatische Säuren, wie z. B. Phthalsäure, sind gute Komplexbildner und somit Maskierungsmittel. Durch Ausbildung von Siebener-Ringen erhält der Komplex eine gewisse „Sperrigkeit“, wodurch diese Teilchen gleichzeitig eine gute Füllwirkung besonders der abfälligen Teile der Haut mitbringen. Daß praktisch alle maskierenden Ionen eine höhere Molekularmasse haben als die der verdrängten Aquoliganden, ist auch ein weiterer Grund für eine bessere Fülle der erzielten Leder. Daß viele Maskierungsmittel auch als Protonenfänger fungieren und somit die Basizität anheben, soll nur am Rande erwähnt bleiben. Mit Hilfe dieser Maskierungsmittel kann ein Chromleder ohne Gefahr einer Überneutralisation gleichmäßig bis zu einem pH-Wert von 4,3± 0,5 entsäuert werden.
Über die Kinetik der Komplexbildung
bei den wichtigen Komplexbildnern wie Acetat und Formiat macht man sich selten richtige Vorstellungen. So sind nach 30 Minuten ca. 25% des eingesetzten Acetats und nur 3,5°/o des Formiats komplex gebunden; wobei diese Werte natürlich von der Chromkonzentration, dem komplexchemischen Aufbau der Temperatur und der maskierenden Salzkonzentration abhängig sind. Für die gerberische Praxis rechnet man mit ca. 15—20 Minuten. Das Optimum der Maskierung bei den üblichen Maskierungsmitteln liegt zwischen 0,5-1,5 Val Maskierungssalz zu 1 Tom Cr ( 1 Tom = 1 Grammatom = 52 g Chrom), wobei die Alterung natürlich eine entscheidende Rolle spielt. Sulfitionen zeigen im Gegensatz zu Sulfationen bereits in der Kälte schon schnelle Komplexstabilisierung durch Maskierung. Alle Maskierungsanionen sind zweizähnig und beteiligen sich als Brückenliganden am Aufbau mehrkerniger Chromkomplexe, wodurch auch die Füllwirkung dieser Gerbstoffe zu erklären ist. Bei Sulfiten können unter bestimmten Versuchsbedingungen sogar hochaggregierte Hydroxosulfitokomplexe in Gelform entstehen.
Parallel mit der Acidokomplexbildung verläuft eine Maskierung. Rein visuell kann man dies an der Farbänderung der Lösung erkennen, von grün nach rotviolett. Spektralanalytisch kann man diese Maskierung verfolgen, da die für dreiwertige Chromverbindungen typischen Absorptionsmaxima (Peak) bei violett 420 nm und gelbgrün 580 nm durch den Eintritt von Acidoliganden verschoben werden.
Veränderung des Gerbstoffes während der Maskierung
Durch den Einbau von Acidoliganden wird der Komplex weitgehend stabilisiert, so daß er weniger Veränderungen durch Protolyse-(Hydrolyse)-Vorgänge unterliegt. Die Bindungsstellen werden gegenüber denjenigen einfacher Chromsalze merklich eingeschränkt, dies führt zur Verringerung der Adstringenz und zum viel tieferen und gleichmäßigeren Eindringen in die Blöße, wodurch eine bessere Chromverteilung erzielt wird. Zu erwähnen sei noch, daß auch die Durchgerbungsgeschwindigkeit und die Ausflockungsbasizität erhöht wird.
Die Veränderungen am Leder zeigen sich durch bessere Fülle, Erhöhung der Schrumpfungstemperatur, durch Verbesserung des Narbenbildes und damit Ausschaltung von Flächenunruhe, Narbenüberladung und Chromnestern. Oft erreicht man auch eine Aufhellung der Lederfarbe durch Einbau bestimmter Anionen, was bei anschließender Färbung in Pastelltönen von Vorteil sein kann. Obwohl man die Chromgerbung durch Maskieren steuern kann, hat sich der Begriff des Maskierungsgrades (Val Maskierungsanion pro Tom Chrom) wenig eingebürgert. Auch die Maskierung verläuft in einer Zeitreaktion, deshalb sind z. B. auch komplexometrische Chrombestimmungen analytisch nicht aktuell. Der Begriff der Maskierung wurde von E. Stiasny in die theoretische Betrachtung der Chromgerbung eingebracht. Der Chemiker versteht unter Maskierung, auch Tarnung genannt, ein Abschirmen eines Schwermetallions gegenüber spezifischen Fällungsmitteln für dieses Ion, meist entstehen anionische Komplexe mit hoher Stabilität. So geben z. B. maskierte dreiwertige Eisensalze mit vegetabilen Gerbstoffen keine Tintenbildung, was bei der Vorgerbung mit Polyphosphaten bei der pflanzlichen Gerbung interessant ist.
Gerbtheorie
Gegen Ende der Gerbung ist die Konzentration optimal aggregierter Chromteilchen in der Haut so groß, daß eine Acidokomplexbildungsreaktion durch die sauren Gruppen der Haut - sogenannte Kollagenationen - mit dem Chrom mit merklicher Geschwindigkeit abläuft. Bei günstiger sterischer Anordnung zweier gegenüberliegender Carboxylgruppen der Polypeptidketten findet die bekannte Vernetzung zweier Kollagenketten über einen angenommenen 4-Kern-Komplex statt.
Als Beweis für eine Vernetzung von Polypeptidketten durch eine Acidokomplexbildung sprechen folgende Tatsachen. Durch die Reaktion der sauren Gruppen der Haut mit dem Chromkomplexteilchen werden die Carboxylgruppen der Haut blockiert, so daß sich der isoelektrische Punkt von pH 5 auf pH 6,6 erhöht. Durch steigende Quervernetzung entsteht eine größere Ordnung der polaren Seitenketten, die eine schärfere Kontrastierung der im Elektronenmikroskop sichtbaren unterteilten Querstreifung mit sich bringt. Diese Positivkontrastierung, die auch mit der Schrumpfungstemperatur im Zusammenhang steht, stellt einen Bindungstest dar. Heteropolysäuren, die mit den Aminogruppen reagieren, rufen im Gegensatz dazu eine Negativ-Kontrastierung hervor. Da das Alkalibindungsvermögen der geäscherten Blöße zwar bedeutend schwieriger zu ermitteln ist als das Säurebindungsvermögen, so nimmt man heute doch großzügig 1 Val Säure oder Alkali pro 1 kg Kollagentrockenmasse an. Daraus läßt sich das optimale spezifische Bindungsvermögen für Chromoxid an die Haut berechnen, obwohl sicherlich beträchtliche Mengen von Chrom unspezifisch durch Einlagerung und Umhüllung gebunden sind („Multipoint“- Bindung). Nimmt man rein theoretisch an, daß ein 4-Kern-Komplex gleich 2 Mol Cr203 über je einen Carboxylatliganden einer Polypeptidkette koordinativ gebunden ist, dann ergibt sich für eine maximale spezifische Bindung folgende Beziehung:
1 Val Base = 1 Mol Cr2O3 / Kollagentrockenmasse
1 kg Kollagentrockenmasse bindet demzufolge 152 g = 15,2% Chromoxid. Beträgt z. B. der Hautsubstanzgehalt eines wasserfreien Chromleders ca. 73%, so könnte dieses Leder maximal 11% Cr2O3 in chemischer Bindung aufnehmen.
Optimale Schrumpfungstemperaturen ( Ts 85 — 100° C) werden jedoch schon bei ca. 20% dieser theoretischen Chrombindung erreicht. Es ist bekannt, daß man bis zu 50% des gebundenen und eingelagerten Chroms z. B. durch Komplexone entfernen kann, ohne daß eine merkliche Entgerbung durch Senkung der Schrumpfungstemperatur zu erkennen ist. Die mittlere Molekularmasse optimal aggregierter, maskierter Chromteilchen ohne Gegenionen beträgt im Durchschnitt ca. 700. Die Umrechnungsfaktoren von Chromoxid (Cr2O3) zum Chromgerbstoffkation betragen im Mittel 2,3—2,4. Ein ähnlicher Faktor, wenn auch aus verständlichen Gründen etwas höher (2,5), errechnet sich wie eingangs erläutert aus den Analysenwerten handelsüblicher Chromgerbsalze. Ein Chromleder mit einem Chromoxidgehalt von ca. 4% enthält annähernd 10% Chromgerbstoff; im Vergleich zu vegetabil gegerbten Ledern mit ca. 35% gebundenem Gerbstoff besitzt dieses eine geringere Gerbintensität. Daraus resultieren die großen Unterschiede in den physikalischen Eigenschaften dieser Lederarten.
Komplexchemische Veränderungen bei der Entsäuerung (Neutralisation) und beim Trocknen der Chromleder
Hauptaufgabe der Neutralisation von Chromleder ist es, die positive Aufladung des Leders nach der Gerbung durch Einbau weiterer komplexaffiner Liganden und durch Säureentzug zu verringern. Dadurch wird die Polarisierung und somit die Affinität des Leders zu den anionischen Körpern wie Farbstoffen und Fettstoffen herabgesetzt. Da die komplexaffinen Neutralisationsmittel von außen einwirken, ist es möglich, nur die Außenschichten oder über den gesamten Querschnitt zu neutralisieren. Bei partieller Neutralisation bleiben die Färb- und Fettstoffe mehr in den Außenschichten, das Leder wird Standiger und satter in der Farbe.
Auch beim Trocknen spielen sich komplexchemische Vorgänge ab, Bekleidungsleder sowie andere Leder werden oft nach einer leichten Vorfettung getrocknet, geschliffen und sortiert. Beim Anfeuchten danach beobachtet man ein vollkommen anderes färberisches Verhalten als beim Färben von frischem Chromleder. Die anionischen Farbstoffe fallen weniger satt an, sie neigen eher dazu durchzuschlagen. Der Grund liegt in einer weiteren Veränderung der Komplexstruktur während des Trocknens. Durch erneuten Eintritt von Anionen wird der Komplex weiter stabilisiert. Die Polarität zwischen Leder und Farbstoff ist noch stärker verringert.
Durch die höhere Temperatur wird die weitere Alterung beschleunigt. Wegen der damit verbundenen Verringerung der inneren Oberfläche, auch wegen der besseren Ordnung der Gitterbausteine, werden die eingelagerten Komplexverbindungen immer reaktionsträger.
Vegetabile Gerbstoffe bilden jedoch Aggregate (Molekülverbände) mit Teilchenmassen nach Reich zwischen 3 000 und 20 000. Bei Annahme von Sphärokolloiden entspricht dies einem Durchmesser zwischen 2 und 4 nm. 1 nm = 10-9 m. Organische Kolloide haben einen Durchmesser zwischen 0,5 und 250 nm, das sind Teilchen, die zwischen 103 und 109 Atome enthalten. Nimmt man eine mittlere Atommasse von 10 an, so entspricht dies bei 103 Atomen einer Molekularmasse von 10 000 mit einem berechneten Durchmesser als Sphärokollid von 0,5 bis 2 nm. Vegetabile Gerbstoffe liegen somit an der unteren Grenze kolloider Dimensionen.
Chromgerbstoffe sind besonders im Anfangszustand der Gerbung kleinteiliger, was unter anderem an ihrer größeren Diffusionsgeschwindigkeit zu erkennen ist.
Kategorien:
Quellenangabe:
Zitierpflicht und Verwendung / kommerzielle Nutzung
Bei der Verwendung von Inhalten aus Lederpedia.de besteht eine Zitierpflicht gemäß Lizenz CC Attribution-Share Alike 4.0 International. Informationen dazu finden Sie hier Zitierpflicht bei Verwendung von Inhalten aus Lederpedia.de. Für die kommerzielle Nutzung von Inhalten aus Lederpedia.de muss zuvor eine schriftliche Zustimmung (Anfrage via Kontaktformular) zwingend erfolgen.
www.Lederpedia.de - Lederpedia - Lederwiki - Lederlexikon
Eine freie Enzyklopädie und Informationsseite über Leder, Ledertechnik, Lederbegriffe, Lederpflege, Lederreinigung, Lederverarbeitung, Lederherstellung und Ledertechnologie