Inhaltsverzeichnis
102 Über die infrarotspektroskopische Untersuchung von Deckfarben und Deckschichten aus dem Jahre 1972
Von H. Herfeld und K. Schmidt
Die Infrarotspektroskopie ist für die Identifizierung der Bestandteile von Deckfarben und Deckschichten besonders wertvoll. In der vorliegenden Veröffentlichung wird die Auswertung der in diesem Bereich erhaltenen IR-Spektrogramme ausführlich diskutiert. Außerdem wird die Vorbereitung der Deckfarben und Deckschichten für die IR-Spektroskopie und die Durchführung der Spektroskopie behandelt, wobei insbesondere auch die Verbesserung der Spektrogramme durch vorherige Fraktionierung der Deckfarben besprochen wird. In einer weiteren Veröffentlichung wird über eine Gruppeneinteilung von Deckfarben auf Grund infrarotspektroskopischer Untersuchungen berichtet werden.
The infrared spectroscopy is very important for identification of the Compounds in finish polymer binders. The preparation of the substances for the spectroscopy, the method of the spectroscopy and the evaluation of the spectrum is shown. The preparative Separation of the different Compounds before the spectroscopy is an important method to get better spectrum.
Der Einsatz von Deckfarben erfolgt auch heute noch zumeist lediglich auf Grund rein empirisch gewonnener bzw. mitgeteilter Anwendungsvorschriften, ein tieferes Eindringen in die Beziehungen zwischen dem Aufbau der eingesetzten Materialien und den erzielten Eigenschaften der Deckschichten wäre mit Erfolg nur möglich, wenn über ihren stofflichen Aufbau möglichst genaue Unterlagen vorlägen. Solche Angaben wurden bisher von den Herstellerfirmen nicht oder höchstens unvollständig bzw. zu summarisch mitgeteilt. Die Identifizierung der chemischen Natur der Bestandteile von Deckfarben und Deckschichten ist andererseits mit den klassischen chemisch-analytischen Methoden nicht möglich. Zwar ist gelegentlich geäußert worden, dass man sich bei der Charakterisierung von Deckfarben mit der Feststellung bestimmter Stoffeigenschaften wie der Acetonlöslichkeit, Thermoplastik, Viskosität, Zugfestigkeit, Kältebeständigkeit und Dehnbarkeit der Deckschichten begnügen könne, aber das ist nur richtig, wenn man den heutigen Zustand der empirischen Entwicklung als befriedigend ansieht. Dieser Zustand ist aber auf die Dauer unerfreulich und rechtfertigt nicht, die Bedeutung der Kenntnisse über die stoffliche Zusammensetzung der Deckfarben für die Qualitätsförderung des Endproduktes grundsätzlich abzulehnen. Nur eine Kenntnis über die analytisch exakt überprüfbare Zusammensetzung eingesetzter Produkte gibt auch dem Praktiker Möglichkeiten, Zusammenreichen bestimmte Energiebeträge. Ist dagegen die eingestrahlte Strahlenfrequenz in anderen Wellenlängenbereichen von der charakteristischen Molekülfrequenz verschieden, so tritt keine Resonanz ein, die Strahlung kann also das Molekül ohne Schwächung der Strahlenenergie passieren. Den erhaltenen Spektren fehlen somit in bestimmten Wellenlängenbereichen ganz bestimmte Energiebeträge, und die an diesen Stellen auftretenden Absorptionsbanden sind charakteristisch für bestimmte Atomgruppierungen, lassen damit Schlüsse auf den chemischen Aufbau der untersuchten Substanz zu und können zu ihrer Identifizierung dienen. Die Lage der einzelnen Absorptionsbanden ist also für bestimmte Atomgruppierungen (z. B. Estergruppe, Aminogruppe, Methylengruppe usw.) charakteristisch. Gleiche Atomgruppierungen absorbieren stets an der gleichen Stelle im Spektrum, und die Kenntnis dieser Gruppenfrequenzen ist daher das wichtigste Mittel für die Charakterisierung eines Moleküls durch das IR-Spektrum. Die Entwicklung der IR-Spektroskopie bietet sich also an, um in Kombination mit entsprechenden Trennungsverfahren komplizierte Stoffsysteme hinsichtlich ihrer Bestandteile zu identifizieren.
Natürlich reichen für die Identifizierung eines bestimmten Stoffes die Schwingungen einer einzelnen Atomgruppierung nicht aus, da die gleiche Atomgruppierung in verschiedenen Stoffen vorkommt und daher überall auch die gleichen Schwingungen verursacht. Entsprechend müssen stets verschiedene Schwingungsmöglichkeiten ausgewertet und zueinander in Vergleich gesetzt werden, und nur wenn alle charakteristischen Absorptionsbanden für die jeweilige Komponente anwesend sind, kann deren Vorhandensein als einwandfrei bewiesen gelten, wie nachstehend an einer Reihe von Beispielen zu erläutern sein wird. Auch für Copolymere, die aus chemisch verschiedenen Monomeren aufgebaut sind und in zahlreichen Mischpolymerisaten handelsüblicher Binder vorliegen, ist in den meisten Fällen die Identifizierung mittels IR-Spektroskopie einfach, da die Monomereinheiten relativ unabhängig voneinander schwingen, nur ist die Intensität der einzelnen Schwingungen je nach dem Gehalt der einzelnen Monomeren unterschiedlich, und bei sehr geringen Anteilen bestimmter Monomeren können deren Schwingungen unter Umständen durch die Schwingungen von mengenmäßig höheren Anteilen eines anderen Monomeren überlagert sein.
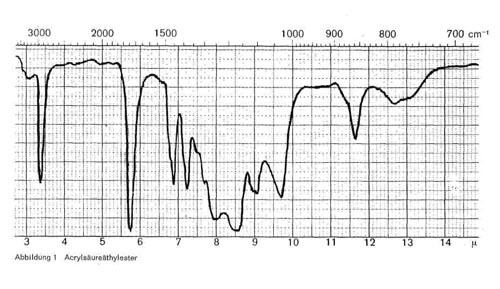
Abbildung 1:
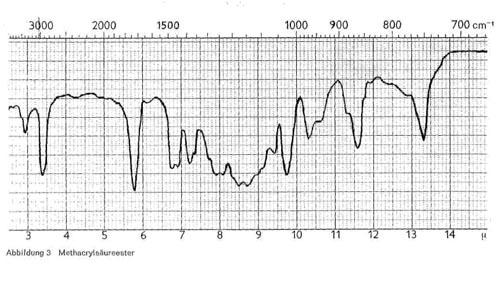
Abbildung 3:
Liegen unveresterte Acrylsäure und Acrylsäureester im Gemisch vor bzw. ist die Acrylsäure nicht vollständig verestert, so ist nur der obere Teil der Bande zwischen 3 und 4 breit ausgebildet und geht darunter in die Esterspitze über (Abb. 2 rechts).
Statt der Acrylsäureester können auch Ester der Methacrylsäure (CH2 = C (CH3) COOH) vorliegen. Der Erweichungspunkt des Polymerisats liegt dann wesentlich höher als bei den Polymerisaten aus Acrylsäureestern, und außerdem sind die optischen Eigenschaften verbessert. Für Polymerisate der Methacrylsäureester gelten die gleichen, oben für Acrylsäureester angeführten Merkmale, nur ist die spitze Bande bei 6,9 nach 6,7-6,8 verschoben und häufig in eine Doppelbande aufgespalten (Abb. 3), und außerdem sind die beiden Schwingungen bei 7,9-8,0 und 8,5-8,6 deutlich in Doppelschwingungen aufgespalten. Eine Mischung von Acrylsäure- und Methacrylsäureestern ist oft schwierig zu unterscheiden, namentlich wenn die letzteren nur in kleinen Mengen vorhanden sind.
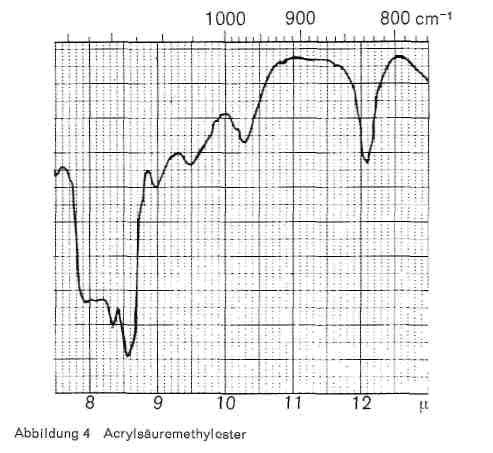
Oben wurde bereits erwähnt, welche Banden für Äthylester charakteristisch sind. Liegt ein Methylester vor, so treten statt dessen für die Methylgruppe charakteristische Banden bei 8,35, 8,60 und 12,1 auf (Abb. 4).
Abbildung 4:
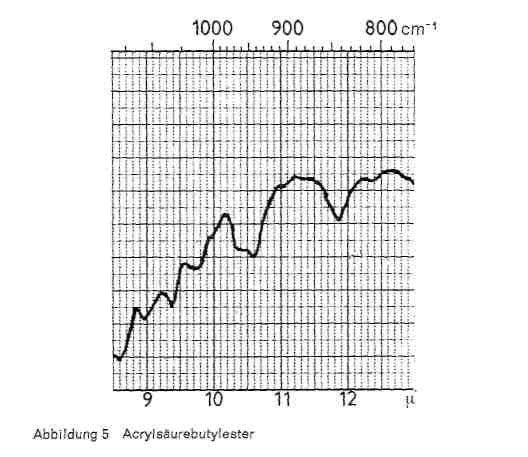
Es kann auch eine kleine Spitze bei 9,5 liegen und eine Bande bei 10,3, die aber auch bei Butadien vorliegt. Beim Butylester liegen die für die Butylgruppe charakteristischen Banden bei 9,3-9,4, eine Doppelschwingung bei 10,4 und 10,6 und eine Bande bei 11,9 (Abb. 5). Dabei ist aber zu beachten, dass eine Bande bei 10,6 auch bei Vinylacetat auftritt (s. u.)- Einpolymerisiertes Polyacrylamid ist durch intensive Absorptionsbanden bei 2,9-3,0; 6,0-6,1 und 8,9-9,0 zu identifizieren.
Abbildung 5:
Schließlich müssen unter den Acrylaten noch Produkte erwähnt werden, die als Mischpolymerisate neben Acrylsäureester und gegebenenfalls freier Acrylsäure auch noch andere Monomere einpolymerisiert enthalten. Ein Zusatz von Styrol (CH2=CH C6H5) macht sich an folgenden Stellen bemerkbar:
- 5-Fingerbande zwischen 5 und 6 (Benzolring). Sie wird im Gemisch mit Estern durch die Esterbande bei 5,8 allerdings stark unterdrückt, so dass dann nicht mehr alle 5 Spitzen sichtbar sind. Oft findet auch durch andere Kombinationen eine Unterdrückung dieser Bande statt (s. u.).
- Spitze Bande bei 6,7.
- Banden bei 13,1-13,2 und bei 14,2-14,3 (Phenylring), die manchmal auch breit ausgeprägt sind, es aber nicht zu sein brauchen.
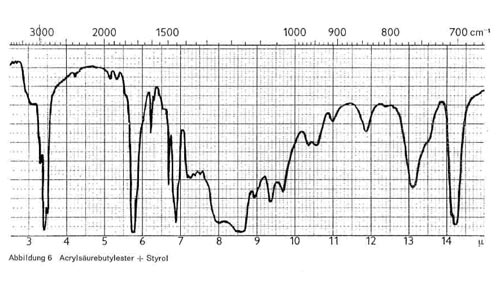
Abb. 6 gibt die IR-Spektren eines Binders wieder, der auf Basis von Acrylsäurebutylester und Styrol aufgebaut ist. In diesem Bild finden sich alle Kennzeichen vereint, die oben als charakteristisch für Acrylate, für die Butylgruppe und für Styrol angeführt wurden.
Abbildung 6:
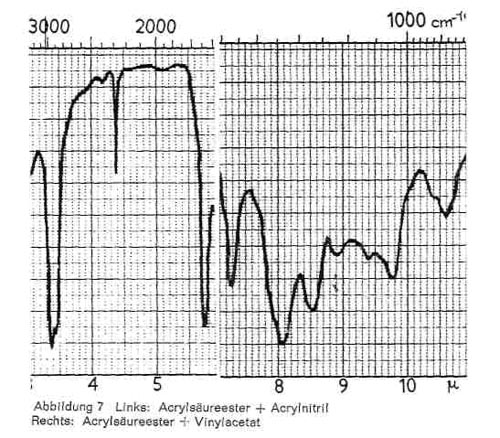
Ein Zusatz von Acrylnitril (CH2 = CH CN) ist an der sehr spitzen Bande bei 4,4-4,5 (C = N) sehr eindeutig zu erkennen (Abb. 7 links). Eine weitere spitze Bande bei 6,9 ist nicht charakteristisch, da sie auch bei den Acrylsäureestern zu finden ist (s. o.). Das Vorhanden sein von Vinylacetat (CH2=CH OOCCH3) macht sich in einer Erniedrigung des Erweichungspunktes bemerkbar. Anteilig wird es häufig als weichmachende Komponente eingesetzt und bewirkt hervorragendes Filmbildungsvermögen und gute Haftfestigkeit. Im IR-Spektrum wirkt es sich an den folgenden Stellen aus (Abb. 7 rechts).
Abbildung 7:
- Bei 7,3 und 8,1 tiefgezogene Bande, für Acetat charakteristisch (C-O-C).
- Kleine Banden bei 8,9 und 9,8.
- Bande bei 10,6; diese Bande findet sich allerdings auch im Butylester (s. o.), sie wird dann durch die Anwesenheit von Vinylacetat verstärkt.
- Bande bei 12,5-12,6, namentlich in Copolymeren auftretend, ist aber nicht sicher. Oft tritt diese Bande in den Fraktionen stärker als im IR-Bild des Originalproduktes auf.
Butadien-Binder
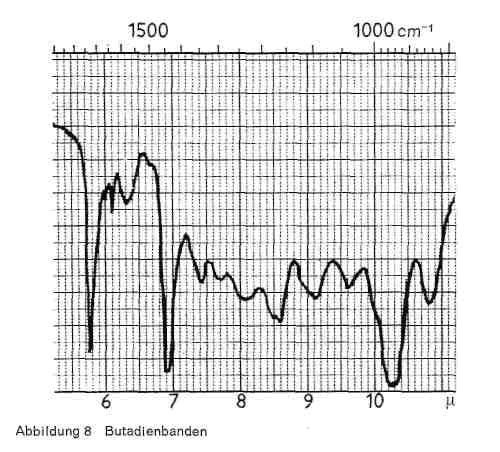
Abbildung 8:
- Butadien (CH2=CH-CH = CH2) gibt, wie Abb. 8 zeigt:
- eine meist ganz kurze Bande bei 6,1 (-C = C-Gruppe)
- eine sehr charakteristische Bande bei 10,3-10,4 (1,4 - Transgruppierung)
- eine Bande bei 10,8-10,9.
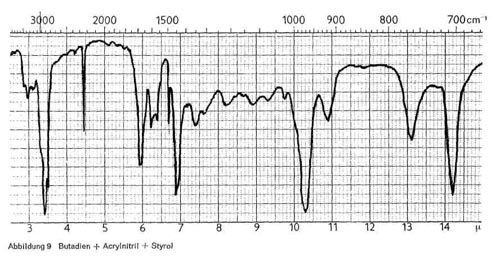
Butadien wird aber nie allein zur Herstellung von Bindern verwendet, da solche Deckschichten zu weich und klebrig wären. Daher werden gleichzeitig andere Monomere mit einpolymerisiert, meist Acrylnitril oder Styrol oder auch beide. Abb. 9 gibt das IR-Spektrum eines Binders wieder, der aus Butadien, Acrylnitril und Styrol aufgebaut ist, und enthält daher alle Banden, die für diese 3 Komponenten oben als charakteristisch angeführt wurden. Die 5-Fingerbande des Styrols ist allerdings nur schwach angedeutet. Wenn in einem solchen Produkt auch noch ein Acrylester zur inneren Weichmachung einpolymerisiert ist, kommen noch die Banden des Acrylesters hinzu.
Polymere Chlorolefine
Abbildung 9:
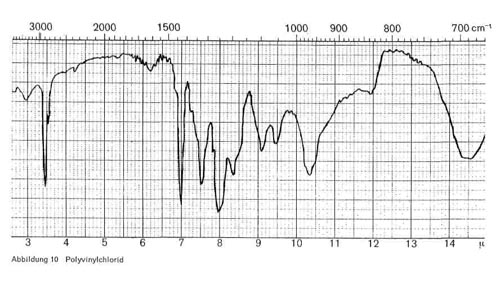
Chlorolefine können in normalen Bindern einpolymerisiert sein oder als Zumischung vorliegen, sie können aber auch als alleinige Grundlage für Filme in Frage kommen. Als Beispiel für die letzte Möglichkeit sei das Polyvinylchlorid (CH2 = CH Cl) angeführt, das zwar in den bei der Lederherstellung verwendeten Bindern kaum vorhanden ist, da es beim Bügeln klebt, aber auf Kunststoffbeschichtungen oder bei der Folienkaschierung auf Leder eingesetzt wird. Für dieses Produkt sind, wie Abb. 10 zeigt, insbesondere Bande bei 7,0; 7,5; 8,0; 9,1; 10,3-10,4; 12,0 und 14,3-14,7 charakteristisch, wobei die letztere CH Cl-Schwingung als breite Bande auftritt. Eine weitere breite Bande bei 15,5-16,5, die ebenfalls für die CH Cl-Gruppe charakteristisch ist, ist in unserer Apparatur nicht mehr zu erfassen.
Abbildung 10:
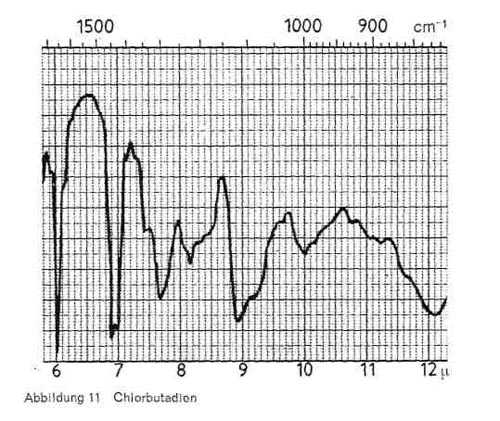
Chlorbutadien (H2C = CH-CCI = CH2) ist als Alleinprodukt oder auch beim Einsatz für Klebstoffe unter den Bezeichnungen Chloropren oder Neopren bekannt, wird aber auch anteilig in Bindern eingesetzt. Das Produkt zeigt, wie Abb. 11 wiedergibt, charakteristische Bande bei 6,0 (sehr spitz); 6,9-7,0 (spitze Doppelschwingung) und breitere Bande bei 8,9-9,0 und bei 12,1.
Abbildung 11:
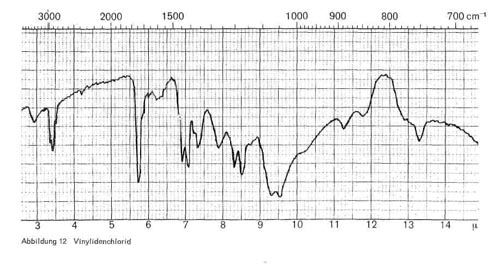
Vinylidenchlorid (CH2=CCl2) ist auch in Bindern als glanzgebende Komponente enthalten. Es zeigt charakteristische Banden bei 3,3-3,4; 7,1; 7,3-7,4; Doppelbande bei 9,35 und 9,6 und einfache Banden bei 11,2 bis 11,3 und bei 13,3 (Abb. 12).
Nitrocellulose (Cellulosenitrat)
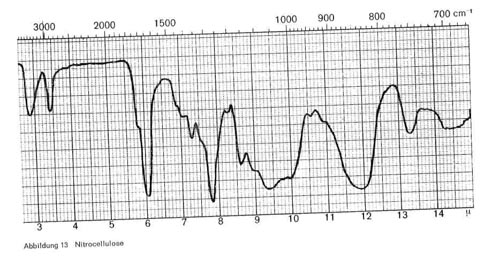
Deckfarben, die auf Basis von Nitrocellulose aufgebaut sind, zeigen, gleichgültig ob es sich um in organischen Lösungsmitteln gelöste oder emulgierte Produkte handelt, die folgenden charakteristischen Banden (Abb. 13):
- 2,9. Die Intensität dieser Bande ist ein Maß für freie OH-Gruppen. Je stärker verestert das Produkt ist, desto geringer ist diese Bande ausgeprägt.
- 6,0-6,1 und 7,8 (ON02-Gruppe)
- Breite Bande bei 9,4 und bei 11,8-12,0.
Abbildung 12:
Abbildung 13:
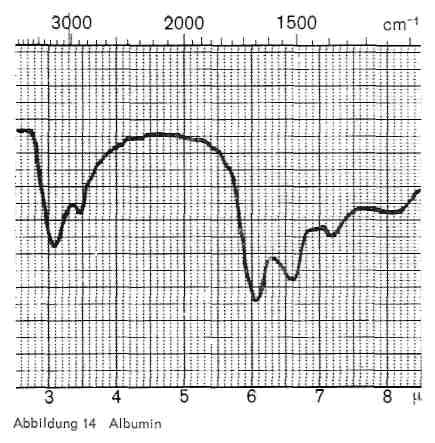
Abbildung 14:
Eiweißstoffe und Polyamide
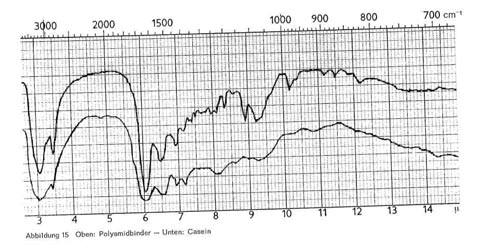
Abbildung 15:
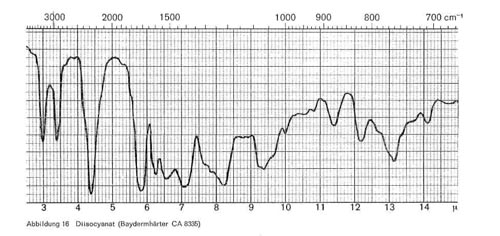
Abbildung 16:
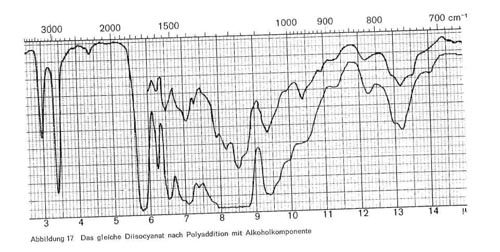
Abbildung 17:
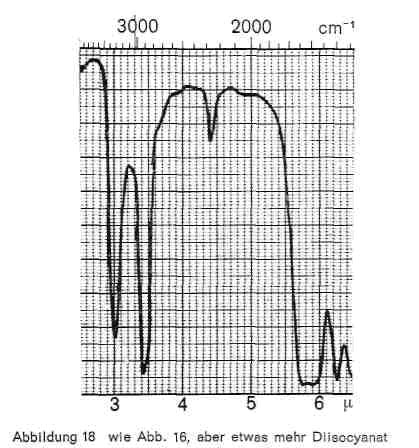
Abbildung 18:
Eiweißstoffe (Albumin und Casein), die in Caseindeckfarben und in technischen Glänzen, aber auch im Gemisch mit Acrylsäureestern vorkommen, sind durch die folgenden Banden charakterisiert (Abb. 14 und 15):
- 3,0-3,1 und 3,4 (NH-Valenzschwingungen)
- 6,0-6,1 und 6,5-6,6 (Amidbande I und II)
- 7,2 (COO-Bande)
- 8,1-8,2 (Amidbande III), oft nur schwer erkennbar.
Die in Deckfarben vorkommenden polyamidartigen Eiweiß-Kondensationsprodukte (im Handel als Luronbinder) zeigen die gleichen Bande wie die Eiweißstoffe. Die Bande 6,5 fehlt bisweilen oder ist nach 6,7 verschoben, die Banden 7,2 und 8,2 sind nur schwach und nicht mit Sicherheit vorkommend. Darüber hinaus haben die Polyamide im Gebiet oberhalb 8 ein wesentlich differenzierteres Spektrum mit zusätzlichen Banden bei 8,3; 8,9; 9,2-9,3; 10,2; 11,5 und 12,2 (Abb. 15). Luronbinder UW zeigt gegenüber Luronbinder W zu sätzlich noch Banden bei 9,7 und 9,9. Im IR-Bild ist nicht festzustellen, ob neben den Polyamidbindern auch Casein anwesend ist.
Polyurethane-Binder
Polyurethane entstehen bekanntlich bei der Polyaddition von polyfunktionellen Isocyanaten mit mehrwertigen Alkoholen oder allgemein mit Molekülen, die reaktive Wasserstoffatome besitzen (Alkohole, Amine, Carbonsäuren, Ester mit endständigen alkoholischen Gruppen). Dabei verschwindet die Isocyanatgruppe nach der Formel: R-N = C = 0 + HOR → R-NH-CO-OR.
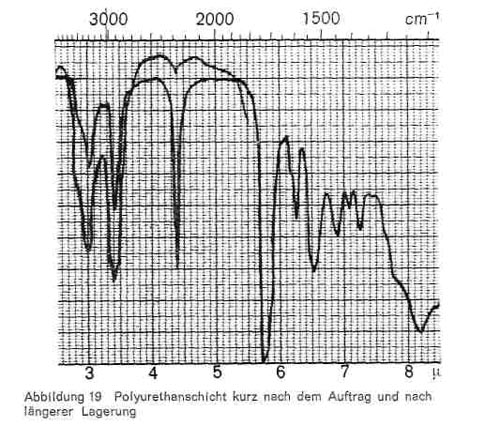
Abbildung 19:
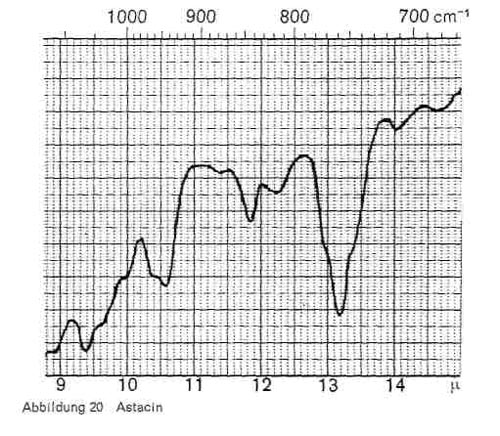
Abbildung 20:
Diese Reaktion, die als Zeitreaktion verläuft und bei mehrfunktionellen Monomeren zu hoch vernetzten und sehr widerstandsfähigen Polyurethanschichten führt, ist im IR-Bild gut erkenntlich. Abb. 16 gibt das Spektrum eines Diisocyanats (Baydermhärter CA 8335) mit den charakteristischen Banden bei 3,0; 3,4; 4,4 (charakteristische Isocyanatbande); 5,8-5,9 (überlagert sich mit der Carbonylschwingung bei Esterstrukturen); 6,2-6,3; 6,5-6,6; 8,2; 9,3-9,4 (Überlagerung mit Schwingungen der Butylgruppe); 12,2 und 13,2. Die einzelnen Handelsprodukte zeigen geringe Unterschiede, haben aber durchweg die oben angeführten Banden gemeinsam. Die Schwingung bei 4,4 ist charakteristisch für die Isocyanatgruppe (-N = C-0) und verschwindet daher in dem Maße, wie diese Gruppe durch die Polyaddition blockiert wird und damit Polyurethane entstehen (Abb. 17), während die übrigen Banden bestehen bleiben. Abb. 18 stellt die gleiche Kombination dar, nur ist mengenmäßig der Anteil an Diisocyanat größer, so dass bei 4,4 noch ein Rest der Isocyanatgruppe erkenntlich ist. Abb. 19 zeigt ebenfalls, wie die Isocyanatgruppe erst in einer Zeitreaktion verschwindet. Von den 2 Kurven wurde die eine unmittelbar nach der Mischung der beiden Komponenten und dem Auftrag der Mischung, die zweite nach längerer Lagerung aufgenommen und zeigt, dass im ersteren Falle die Reaktion noch kaum stattgefunden hat (starkes Hervortreten der Bande bei 4,4), während sie bei der zweiten Kurve fast beendet ist. Man kann also im IR-Bild solcher Polyurethanschichten deutlich erkennen, wie weit die Polyaddition fortschreitet, bzw. ob ein Überschuss des Diisocyanats vorliegt. Abb. 20 gibt schließlich das IR-Spektrum eines anderen Polyurethans wieder, bei dem zur Polyaddition nicht ein mehrwertiger Alkohol, sondern ein Hydroxylgruppen enthaltender Acrylsäurebutylester eingesetzt wurde (Astacin). Wir sehen hier neben den Banden des Polyurethans bei 9,3-9,4, 12,2 und 13,2 die charakteristische Doppel-Schwingung der Butylgruppe bei 10,4 und 10,6 und die Bande bei 11,9. In manchen handelsüblichen Produkten ist auch Nitrocellulose enthalten, wobei sich dann im IR-Bild auch die typischen Banden der Nitrocellulose neben denen des Polyurethans bemerkbar machen.
Emulgatoren
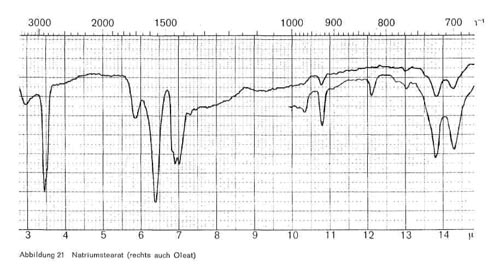
Abbildung 21:
Abbildung 22:
Abbildung 23:
Abbildung 24:
In den meisten Binderdispersionen sind von der Herstellung her gewisse Mengen an Emulgatoren vorhanden, die in den IR-Spektren zusätzliche Banden geben, die die Aufklärung der Zusammensetzung der Handelsprodukte erschweren können, wenn man sie nicht zuordnen kann. Bei der später noch zu besprechenden fraktionierten Aufteilung der Dispersionen werden sie in der Wasserfraktion und in der Gefrierfraktion bevorzugt, aber auch teils schon in der Ätherfraktion auftreten. Hier seien daher die IR-Spektren der wichtigsten praktisch vorkommenden Typen von Emulgatoren behandelt, wenn auch nur gruppenweise zusammengefasst, da die Zahl der Handelsmarken viele Hunderte von Individuen umfasst:
- Seifen (R COO Me). Die wichtigsten Vertreter dieser Klasse sind Natriumlaurat, Natriummyristat, Natriumpalmitat, Natriumstearat und Natriumoleat. Die wichtigsten Banden dieser Gruppe liegen bei 3,4-3,5; 6,4; Doppelbande bei 6,9-7,0; 10,8 (spitz); 13,8-13,9 und 14,3-14,4 (Abb. 21). Dagegen verschwindet bei der Seifenherstellung beim Übergang der Carboxyl-säure in ihre Salze die für Ester charakteristische Bande bei 5,7-5,8, und es treten dafür die beiden für die Carboxylatstruktur bei carbonsauren Salzen typischen Banden bei 6,4 und 6,9-7,0 auf. Die Bande bei 13,8-13,9 tritt stets bei langen CH2-Ketten auf.
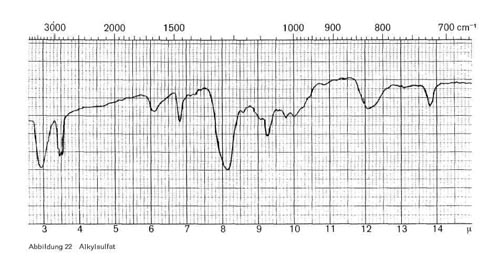
- Alkylsulfate (Fettalkoholsulfate) werden durch Veresterung der Fettalkohole mit Schwefelsäure erhalten (RO SO3 Na). Die Spektren der primären n-Alkylsulfate sind sich untereinander sehr ähnlich und zeigen Banden bei 3,4-3,5; 6,8; 8,0-8,2 (Sulfatbande); 9,3 bis 9,4; breite Bande bei 12,0-12,2; 13,8-13,9 (Abb. 22). Die Bande bei 13,8-13,9 ist wieder typisch für lange CH2-Ketten. Primäre und sekundäre Alkohole lassen sich deutlich durch die Absorption bei 12,0 bis 12,2 oder 10,7 unterscheiden.
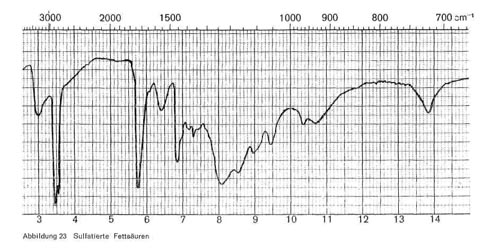
- Sulfatierte Fettsäuren entstehen durch Addition der Schwefelsäure an die Doppelbindung der meist ungesättigten öle und enthalten im Molekül nebeneinander eine endständige Carboxylgruppe und eine mittelständige Sulfatgruppe. Im IR-Spektrum (Abb. 23) sind charakteristisch für die Carboxylgruppe die Banden bei 3,4-3,5; 5,7-5,8 und 6,4, für die Sulfatgruppe die Banden der COS-Schwingung bei 8,0-8,2; 9,3-9,4 und 10,3. Außerdem ist charakteristisch noch eine breite Bande bei 10,5-11,0 und eine Bande bei 13,8 bis 13,9, die stets bei langen CH2-Ketten auftritt. Ist die Fettsäure verestert, so tritt die Esterbande bei 5,7 bis 5,8 stark hervor, und die Carboxylbande bei 6,4 wird schwach, bei sulfatierten freien Fettsäuren ist es umgekehrt.
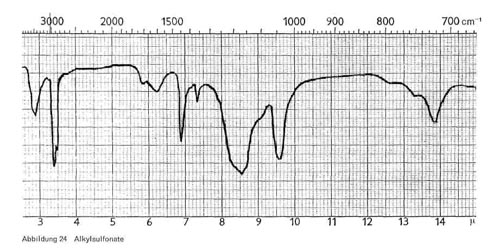
- Alkylsulfonate (Mersolate; RSO3Na), also Substanzen mit echter Sulfogruppe (Abb. 24). Charakteristisch sind die Bande bei 3,4-3,5 und 6,9, für die Sulfongruppe eine breite Bande bei 8,5 und eine Bande bei 9,6. Schließlich sei auch hier wieder die Bande von 13,8-13,9 für längere CH2-Ketten erwähnt.
- Alkylarylsulfonate (R C6H4 SO3 Na) haben die gleichen Banden wie die Alkylsuifonate, nur treten für den Benzolring noch zusätzliche Bande bei 6,2 und 9,9 auf.
- Polyäther (Äthylenoxydaddukte; abgekürzt Äoaddukte), entstehen bei der Anlagerung von Äthylenoxyd an Fettsäuren, Fettalkohole, Alkylphenole usw. (z. B. RO (CH2 CH2 CH2 OH). Hierher gehören alle Produkte, die 2 oder mehr Äthylenoxydgruppen im Molekül enthalten. Die Zahl der Handeisprodukte dieser Gruppe ist außerordentlich groß. Ihre Wasserlöslichkeit ist durch die Häufung der Äthergruppen im Molekül bedingt, an die sich Wasser anlagert.
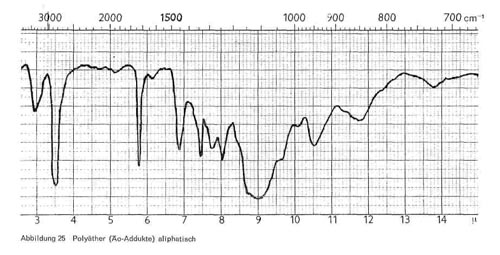
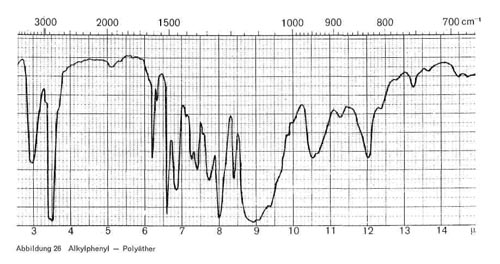
Soweit es sich um aliphatische Polyglykoläther handelt, haben sie, wie Abb. 25 zeigt, charakteristische Bande bei 3,4-3,5; 5,7-5,8 (Esterbande, nicht bei allen Produkten vorhanden); 7,4; 8,0-8,1; breite Ätherbande bei 8,9-9,1; 10,5-10,6; breite Bande bei 11,6 bis 12,0; 13,8-13,9. Die beiden letzteren Banden sind nicht immer vorhanden und werden mit zunehmender Oxyäthylenzahl immer intensiver. Sind auch aromatische Gruppen enthalten, so kommen noch Bande bei 6,2 und 9,9 für den Benzolring hinzu (Abb. 26).
Weichmacher
Abbildung 25:
Abbildung 26:
Abbildung 27:
Abbildung 28:
Da auch Weichmachungsmittel in bestimmten Deckfarbentypen vorhanden sind, seien auch für die hauptsächlichen Vertreter dieser Gruppe die charakteristischen Bande im IR-Bild angeführt. Niedermolekulare Weichmacher treten bei fraktionierten Extraktionen vorwiegend im Ätherauszug auf.
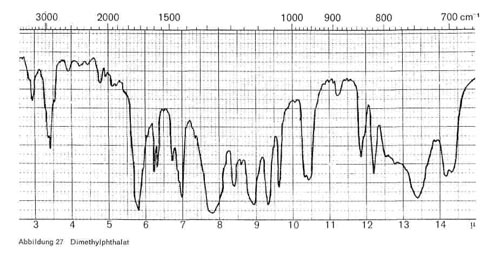
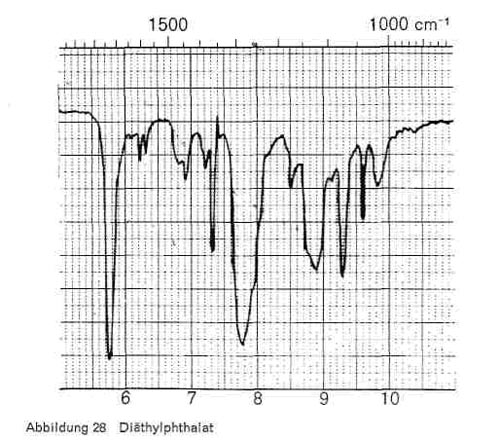
Phthalsäureester. Alle Phthalsäureester haben die für veresterte Phthalsäure charakteristischen Bande bei 6,25 und 6,35 (2 kleine Spitzen); 7,7-7,8 (breiteres Band); 8,9; 9,3-9,4; 13,4-13,5 und 14,2. Dazu kommen natürlich noch die Esterbanden bei 3,4 und 5,7-5,8. Die einzelnen Ester haben außerdem noch folgende Bande:
- Dimethylphthalat: 7,0; 8,35; 12,1-12,2 (Abb. 27)
- Diäthylphthalat: 7,2; 7,35; 9,7-9,8 (Abb. 28)
- Dibutylphthalat: 7,2-7,3; Doppelschwingungen bei 10,4 und 10,6; 11,9.
- Benzylbutylphthalat: wie Dibutylphthalat, außerdem noch 14,4 (Benzylrest), dafür nicht 14,2.
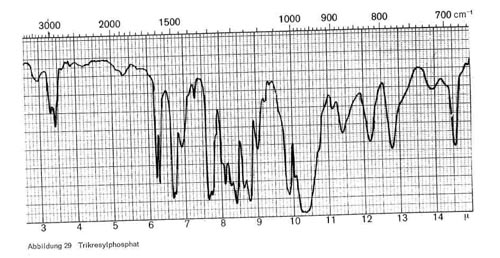
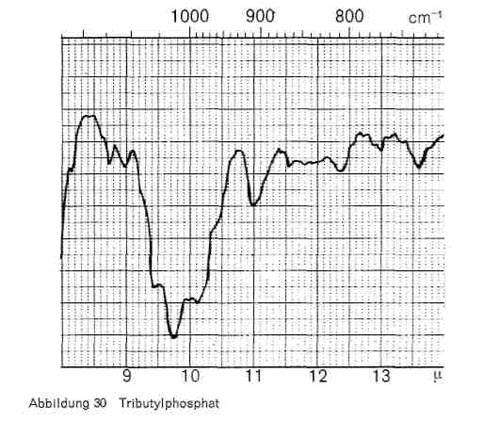
Phosphorsäureester. Alle Phosphorsäureester nahen, wie Abb. 29 zeigt, die charakteristischen Schwingungen bei 3,4-3,5, 7,7-7,8; 8,1 und 9,7-9,9. Beim Trikresylphosphat kommen noch Schwingungen bei 11,4; 12,2; 12,8 und 14,6, beim Tributylphosphat (Abb. 30) bei 7,25 und 13,6 hinzu.
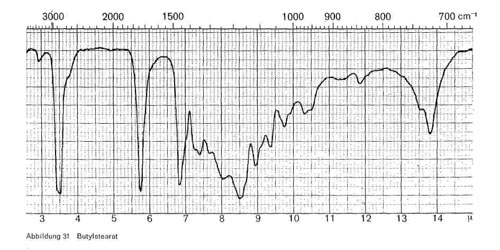
Butylstearat. Neben den Esterbanden bei 3,4 und 5,7-5,8 gibt das Butylstearat charakteristische Banden bei 8,55; 9,3-9,4 und 13,8-13,9 (Abb. 31).
Abbildung 29:
Abbildung 30:
Wichtigste Banden bei der Identifizierung von Bindemitteln, Emulgatoren und Weichmachern in Deckfarben und Deckschichten.
Im vorhergehenden Abschnitt wurden für alle Gruppen von Bindemitteln, Emulgatoren und Weichmachern, die in Deckfarben und Deckschichten vorkommen können, die typischen Banden der IR-Spektren besprochen. Um die Identifizierung zu erleichtern, werden nachstehend nochmals alle vorkommenden Banden in der Reihenfolge steigender Wellenlänge (in Mikrometer um) angegeben. Wenn dabei insbesondere in den Mittelbereichen eine Reihe von Banden zusammengefasst werden, so heißt das nicht, dass es sich um chemisch gleichartige Schwingungen handelt. Gleichzeitig werden in Klammern auch die zugehörigen Wellenzahlen (in cur1) angeführt, die bisweilen in anderen Veröffentlichungen zu finden sind.
Abbildung 31:
Tabelle 1:
Vorbereitung der zu untersuchenden Deckfarben für die Analyse
Ein IR-Spektrum ist um so besser zu interpretieren, je größer die chemische Einheitlichkeit des zu untersuchenden Stoffes ist. Bei den Deckfarben und Deckschichten ist diese Voraussetzung aber zumeist nicht gegeben. Ganz abgesehen davon, dass in vielen Fällen Mischpolymerisate vorliegen, enthalten die handelsüblichen Produkte auch nach Verdunsten der Lösungsmittel neben dem Bindemittel noch Pigmente, Weichmacher, Emulgatoren, Schutzkolloide und Stabilisatoren. Es würde ein viel zu teures, zu arbeitsaufwendiges und praktisch auch kaum durchführbares Unterfangen darstellen, die einzelnen Komponenten isolieren zu wollen. Will man aber eine gründliche Untersuchung durchführen, so hat sich eine Fraktionierung der Dispersionen mit verschiedenen Lösungsmitteln als zweckmäßig erwiesen, und es erschien uns besonders wichtig, diesen Trennungen durch Fraktionierung unsere besondere Aufmerksamkeit zu schenken.
Für diese Fraktionierung verwenden wir Metallfolienstreifen, bei denen der Rand etwas hoch gebogen wurde. Eine gewisse Menge (je nach Konzentration 5-20 g) der Bindemitteldispersion wird auf diese Folie gegossen, und nach Abdunsten des Lösungsmittels werden die Folien zusammengerollt und im Soxhletgerät mit Lösungsmitteln in der Reihenfolge Benzin, Äther, Wasser, Methylenchlorid und Tetrahydrofuran behandelt. Mit jedem Lösungsmittel wird vier Stunden extrahiert, dann wird das Lösungsmittel abdestilliert, die Folie gut ausgetrocknet und mit dem nächsten Lösungsmittel weiter, behandelt. Bei jeder Fraktion wird das Lösungsmittel zunächst sorgfältig abgedampft und der Rückstand dann für die IR-Spektroskopie verwendet. Die Lösungsmittelfraktionierung gibt nicht unter allen Umständen eine klare Trennung; die Stoffe, die eigentlich erst in der Wasserfraktion hätten in Lösung gehen sollen, erschienen beispielsweise häufig schon in der Ätherfraktion, aber ganz allgemein kann festgestellt werden, dass durch die Untersuchung der einzelnen Fraktionen doch viel klarere IR-Spektrogramme vorlagen und damit ein wesentlich besserer Einblick in die Zusammensetzung der Produkte erhalten wurde, als das bei der Untersuchung des Originalgemisches der Fall war. Ein anderes Verfahren, das wir in vielen Fällen auch mit großem Erfolg angewandt haben, war die Ausfällung des Bindemittels durch Gefrieren, wobei die Dispersion 4-5 Stunden bei -20° gelagert und dann das ausgeflockte Bindemittel abfiltriert wird. Die übrigen Bestandteile (Weichmachungsmittel, Emulgatoren usw.) sind dann in der Gefrierfraktion wesentlich eindeutiger als im Ursprungsprodukt zu erkennen. Will man keine Fraktionierung durchführen, so kann man in vielen Fällen die unlöslichen Pigmente auch dadurch abtrennen, dass man die Deckfarbe mit einem geeigneten Lösungsmittel bzw. Lösungsmittelgemisch verdünnt und anschließend zentrifugiert. Falls die Lösung nach Abzentrifugieren stark gefärbt bleibt, so deutet das auf organische Pigmente hin.
Arbeiten in Lösung
Substanzen, die in organischen Lösungsmitteln löslich sind, können mit einer Pipette in eine Küvette mit Kochsalzfenstern eingespritzt werden und in dieser Form Spektroskopien werden. Dabei muss in einer zweiten Küvette das gleiche Lösungsmittel ohne Substanz im Vergleichsstrahl zum Auskompensieren des Lösungsmittelspektrums eingeschaltet werden, so dass im endgültigen Spektrogramm nur das Spektrum der gelösten Substanz erscheint.
Mikroschnitte
Die Herstellung von Mikroschnitten von festen Polymeren gelingt nur in wenigen Fällen, wobei die Materialien weder zu hart noch zu weich sein dürfen. Bei zu weichen Polymerisaten läßt sich häufig mit Gefriermikrotom die für die Herstellung der Schnitte erforderliche Härte einstellen.
Vorbereitung von Deckschichten für die Analyse
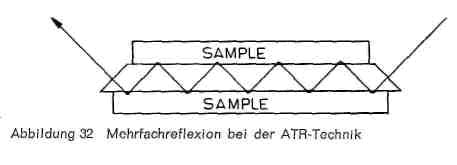
Abbildung 32:
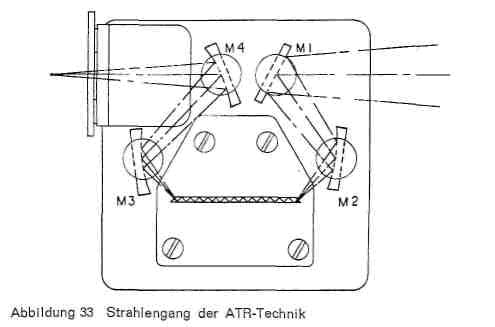
Die Analyse von Deckschichten auf Leder stellt insofern zusätzliche Anforderungen an die Vorbereitung, als die meisten Deckbeschichtungen aus verschiedenen Schichten mit unterschiedlicher Beschaffenheit bestehen. Es genügt dann in den meisten Fällen nicht, die Polymerisate im Gesamtfilm zu kennen, sondern die Kenntnis der Zusammensetzung der einzelnen Schichten (Schichtaufbau) ist vielfach von entscheidender Bedeutung, wenn beispielsweise Beschichtungsfehler aufgeklärt werden sollen. Um das zu erreichen, wird die ATR-Technik (attenuated total reflection, abgeschwächte Totalreflexion) angewandt, eine Variante der Reflexionsspektroskopie. Gegenüber der üblichen Infrarotspektroskopie wird die Probe nicht durchstrahlt, sondern ihre Oberfläche von einem Strahlengang abgetastet (Abb. 32). Die zu untersuchende Probe wird dabei mit der abgedeckten Seite beidseitig in direkten Kontakt mit der reflektierenden Fläche eines Kristalles aus einem Material mit möglichst hohem Brechungsindex gebracht und das Ganze nun in ein aus mehreren Spiegeln bestehendes Zusatzgerät (Abb. 33) eingebracht. Der Strahl wird dabei von der angeschliffenen Schmalseite des Kristalls aufgefangen, durchläuft diesen zickzackartig, tastet dabei die beiden Oberflächen der zu untersuchenden Proben ab und tritt an der anderen Seite wieder aus, um durch weitere Spiegel dann in den Spektrograph selbst geleitet zu werden. Der Einfallswinkel des Strahls auf die reflektierende Prismenfläche wird so gewählt, dass Totalreflexion eintritt. Die Totalreflexion wird in den Wellenlängenbereichen abgeschwächt, in denen die Proben Absorptionsbanden besitzen, da die Reflexion nicht direkt an der Grenzfläche stattfindet, sondern der Strahl etwas in die Oberfläche des Materials eindringt, das unmittelbar an die Kristallfläche angrenzt. Dabei ist natürlich Voraussetzung, dass die Probe einen sehr innigen Kontakt mit der Prismenfläche hat und dass die reflektierenden Flächen peinlich sauber sind. Je besser die Flächenverbindung durch Verschraubung erreicht wird, desto größer die Absorption. Da die Reflexionen sich mehrfach wiederholen, wird die Absorption additiv verstärkt und eine genügende Intensität der Absorption erreicht, wenn am geeignetsten ist. Auch die von Fischer und Leuckroth beschriebene Methode, die Deckschicht wie bei der Haftfestigkeitsprüfung vom Leder abzuziehen und auch ihre Rückseite zu spektroskopieren, führt in manchen Fällen zum Ziel, wenn der Auftrag nur aus zwei Schichten besteht.
Abbildung 33:
Nachstehend seien zwei Beispiele angegeben. Das Leder, dessen Spektren in Abb. 34 wiedergegeben sind, erhielt eine Grundierung mit einem Acrylatbinder, dann den Auftrag eines Butadienbinders und schließlich einen Nitrocellulose-Schlussauftrag. Das Spektrum I zeigt deutlich den obersten Nitrocelluloseauftrag wobei die charakteristischen Banden bei 6,0-6,1; 7,8; 9,4 und 11,8-12,0 durch Kreuze angezeichnet sind. Im Spektrum II ist die Nitrocelluloseschicht fast völlig verschwunden und dafür sind die Butadienbanden bei 10,3-10,4 und schwächer bei 10,8-10,9 hervorgetreten. Welche anderen Komponenten sich in dem Butadienbinder befinden, ist verhältnismäßig schwer zu erkennen, ein Hinweis auf Acrylnitril ist bei 4,4-4,5 nur schwach angedeutet. Im Spektrum III ist auch das Butadienbild wieder verschwunden, und wir haben das charakteristische Diagramm eines Acrylsäureäthylesters mit den Banden bei 3,4; 5,7-5,8; 6,9; 7,9-8,0; 8,5-8,6; 9,0-9,1; 9,7-9,8 und 11,7. In Abb. 35 haben wir die Spektren eines Leders, bei dem wieder ein Acrylatbinder zur Grundierung verwendet, dann ein Butadienbinder aufgetragen wurde und schließlich ein Abschluss mit einem Luronbinder (polyamidartiges Produkt) erfolgte. Das Spektrum l zeigt für die Oberfläche die typischen Kurven eines Luronbinders mit den Banden bei 3,0-3,1; 3,4; 6,1; 6,5-6,6; 7,2; 8,1-8,2; 8,9; 9,2 bis 9,3; 10,2 und 11,5. Dann folgt im Spektrum II die charakteristische Bande bei 10,3-10,4 für den Butadienbinder, und im Anschluss daran folgen im Spektrum III wieder die Banden eines Acrylsäureäthylesters.
Die Feststellungen sind nicht in allen Fällen so eindeutig wie in den beiden hier skizzierten Beispielen. Durch Vermischung der einzelnen Schichten ergeben sich bisweilen Unklarheiten. Die angeführte Methode gestattet aber in vielen Fällen, den schichtmäßigen Aufbau in der Deckschicht zu erkennen und kann daher für eine Beratung bei auftretenden Deckfarbenfehlern wertvolle Anhaltspunkte geben. In anderen Fällen konnten wir bei Vorliegen eines verarbeiteten Schuhes und gleichzeitiger Untersuchung des unverarbeiteten Leders feststellen, ob in der Schuhfabrik ein Finish aufgetragen wurde und auf welcher Basis dieser aufgebaut war. Die Infrarotspektroskopie vermag also auch in solchen Fällen bei Reklamationen wertvolle Aufschlüsse zu geben.
Wir danken dem Bundeswirtschaftsministerium für die uns über die Arbeitsgemeinschaft industrieller Forschungsinstitute (AIF) übermittelte finanzielle Unterstützung dieser Arbeit. Ferner danken wir Herrn Dr. Pauckner für viele Ratschläge bei der Auswertung der IR-Diagramme.
Literaturangaben
- Vergl. z. B. H. E. Nursten und C. H. Pearson, JSLTC 1964, 456 H. E. Nursten und D. W. Selby, JSLTC 1966, 317 L. Müller, G. Reich und F. Stather, Das Leder 1966, 221 W. Fischer und G. Leuckroth, Gerbereiwissenschaft und -Praxis 1937, 136; 1938, 196
- Vergl. z. B. Hummel/Scholl, Atlas der Kunststoff-Analyse, Band I, Teil 1 und 2, Carl-Hanser-Verlag München, 1968
- Siehe E. Götte, Das Leder 1951, 102 D. Hummel, Analyse der Tenside, Carl-Hanser-Verlag, München 1962 H. König, Neuere Methoden zur Analyse von Tensiden, Springer-Verlag Berlin und Heidelberg 1971
Kategorien:
Quellenangabe:
Zitierpflicht und Verwendung / kommerzielle Nutzung
Bei der Verwendung von Inhalten aus Lederpedia.de besteht eine Zitierpflicht gemäß Lizenz CC Attribution-Share Alike 4.0 International. Informationen dazu finden Sie hier Zitierpflicht bei Verwendung von Inhalten aus Lederpedia.de. Für die kommerzielle Nutzung von Inhalten aus Lederpedia.de muss zuvor eine schriftliche Zustimmung (Anfrage via Kontaktformular) zwingend erfolgen.
www.Lederpedia.de - Lederpedia - Lederwiki - Lederlexikon
Eine freie Enzyklopädie und Informationsseite über Leder, Ledertechnik, Lederbegriffe, Lederpflege, Lederreinigung, Lederverarbeitung, Lederherstellung und Ledertechnologie